题目内容
用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案.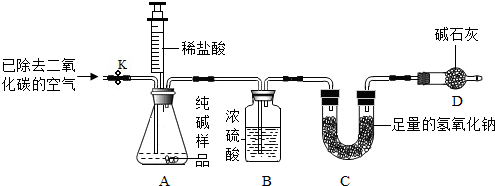
资料摘要:碱石灰常用于吸收水蒸气和二氧化碳
【方案一】利用样品与氯化钙溶液反应产生的沉淀来测定Na2CO3的质量分数.
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)滴加CaCl2溶液要足量的原因: .
(3)将反应后的混合物过滤,对沉淀物进行洗涤、干燥、称量.利用沉淀物的质量计算Na2CO3的质量分数.如不洗涤沉淀会造成测定结果 (填“偏大”或“偏小”).
【方案二】利用样品与稀盐酸反应产生的气体来测定Na2CO3的质量分数.
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好).
(4)连接好装置A和B,打开止水夹K.通入已除去CO2的空气,以排尽装置A和B中含有的 ,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应).待装置A中的反应结束后,再一次打开止水夹K,继续往装置内通入已除去CO2的空气,目的是 ,装置B的作用是 .装置 (填标号)在反应前后的质量差就是产生CO2的质量,由此可计算出样品中Na2CO3的质量分数.装置D的作用是 .
(6)有一同学建议用稀硫酸代替稀盐酸进行实验,可减少因 而造成的误差.

资料摘要:碱石灰常用于吸收水蒸气和二氧化碳
【方案一】利用样品与氯化钙溶液反应产生的沉淀来测定Na2CO3的质量分数.
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加足量的CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式: |
(2)滴加CaCl2溶液要足量的原因:
(3)将反应后的混合物过滤,对沉淀物进行洗涤、干燥、称量.利用沉淀物的质量计算Na2CO3的质量分数.如不洗涤沉淀会造成测定结果
【方案二】利用样品与稀盐酸反应产生的气体来测定Na2CO3的质量分数.
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好).
(4)连接好装置A和B,打开止水夹K.通入已除去CO2的空气,以排尽装置A和B中含有的
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应).待装置A中的反应结束后,再一次打开止水夹K,继续往装置内通入已除去CO2的空气,目的是
(6)有一同学建议用稀硫酸代替稀盐酸进行实验,可减少因
考点:实验探究物质的组成成分以及含量,气体的净化(除杂),盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【方案一】
碳酸钠和氯化钙反应生成碳酸钙沉淀个氯化钠;
为了使碳酸钠完全反应,要滴加足量的氯化钙溶液;
如不洗涤沉淀碳酸钙,碳酸钙上会附着少量的氯化钙、氯化钠等物质;
【方案二】
(4)为了使实验结果更准确,应该把装置A和B中的二氧化碳排尽;
(5)为了使生成的二氧化碳都被氢氧化钠溶液吸收,装置A中的反应结束后,应该再一次打开止水夹K,继续往装置内通入已除去二氧化碳的空气;
浓硫酸具有吸水性,可以用作二氧化碳的干燥剂;
C装置中反应前后的质量差即为反应产生二氧化碳的质量;
为了防止空气中的水蒸气和二氧化碳进入C装置中影响实验结果,应该用碱石灰进行吸收;
(6)盐酸容易挥发,稀硫酸不容易挥发.
碳酸钠和氯化钙反应生成碳酸钙沉淀个氯化钠;
为了使碳酸钠完全反应,要滴加足量的氯化钙溶液;
如不洗涤沉淀碳酸钙,碳酸钙上会附着少量的氯化钙、氯化钠等物质;
【方案二】
(4)为了使实验结果更准确,应该把装置A和B中的二氧化碳排尽;
(5)为了使生成的二氧化碳都被氢氧化钠溶液吸收,装置A中的反应结束后,应该再一次打开止水夹K,继续往装置内通入已除去二氧化碳的空气;
浓硫酸具有吸水性,可以用作二氧化碳的干燥剂;
C装置中反应前后的质量差即为反应产生二氧化碳的质量;
为了防止空气中的水蒸气和二氧化碳进入C装置中影响实验结果,应该用碱石灰进行吸收;
(6)盐酸容易挥发,稀硫酸不容易挥发.
解答:解:【方案一】
(1)碳酸钠和氯化钙反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)滴加CaCl2溶液要足量的原因是使碳酸钠完全反应.
故填:使碳酸钠完全反应.
(3)如不洗涤沉淀碳酸钙,则少量的氯化钙、氯化钠会附着在碳酸钙上,会导致计算的碳酸钠质量偏大,从而导致计算的碳酸钠的质量分数偏大.
故填:偏大.
【方案二】
(4)连接好装置A和B,打开止水夹K.通入已除去CO2的空气,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
故填:二氧化碳.
(5)继续往装置内通入已除去CO2的空气,目的是使生成的二氧化碳全部被C装置中的氢氧化钠溶液吸收,装置B的作用是干燥二氧化碳气体.装置C在反应前后的质量差就是产生CO2的质量,装置D的作用是防止空气中的水和二氧化碳进入装置C中.
故填:使生成的二氧化碳全部被C装置中的氢氧化钠溶液吸收;干燥二氧化碳气体;C;防止空气中的水和二氧化碳进入装置C中.
(6)用稀硫酸代替稀盐酸进行实验,可减少因盐酸的挥发而造成的误差.
故填:盐酸的挥发.
(1)碳酸钠和氯化钙反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)滴加CaCl2溶液要足量的原因是使碳酸钠完全反应.
故填:使碳酸钠完全反应.
(3)如不洗涤沉淀碳酸钙,则少量的氯化钙、氯化钠会附着在碳酸钙上,会导致计算的碳酸钠质量偏大,从而导致计算的碳酸钠的质量分数偏大.
故填:偏大.
【方案二】
(4)连接好装置A和B,打开止水夹K.通入已除去CO2的空气,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
故填:二氧化碳.
(5)继续往装置内通入已除去CO2的空气,目的是使生成的二氧化碳全部被C装置中的氢氧化钠溶液吸收,装置B的作用是干燥二氧化碳气体.装置C在反应前后的质量差就是产生CO2的质量,装置D的作用是防止空气中的水和二氧化碳进入装置C中.
故填:使生成的二氧化碳全部被C装置中的氢氧化钠溶液吸收;干燥二氧化碳气体;C;防止空气中的水和二氧化碳进入装置C中.
(6)用稀硫酸代替稀盐酸进行实验,可减少因盐酸的挥发而造成的误差.
故填:盐酸的挥发.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列说法或做法正确的是( )
| A、霉变的大米洗净后可食用 |
| B、铁在潮湿的空气中不容易生锈 |
| C、熟石灰用于改良酸性土壤 |
| D、为使粮食增产大量使用化肥和农药 |
下列各物质的溶液长期敞口放置在空气中,质量增加并且易变质的是( )
| A、浓硫酸 | B、浓氢氧化钠 |
| C、浓盐酸 | D、浓食盐水 |
 水是宝贵的自然资源,是人类生命之源.
水是宝贵的自然资源,是人类生命之源.