题目内容
12.如图是小明配制100g溶质质量分数为12%的NaCl溶液的有关实验操作示意图.
(1)配制过程中使用玻璃的仪器,主要是烧杯、玻璃棒、量筒.
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果砝码与药品位置放反了.
(3)如果氯化钠中含有少量不溶的杂质,溶质的质量分数为偏小(填“偏大”或“偏小”);量取水最好选择③的量筒(填序号①10mL②50mL③100mL).(水的密度为1g/cm3)
分析 (1)实验室图中的玻璃仪器,进行分析解答.
(2)根据托盘天平的使用要遵循“左物右码”的原则,进行分析解答.
(3)如果氯化钠中含有少量不溶的杂质,会造成实际所取的溶质的质量偏小,结合溶剂质量=溶液质量-溶质质量,进行分析解答.
解答 解:(1)配制过程中使用玻璃仪器,主要是烧杯、玻璃棒、量筒.
(2)托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了.
(3)如果氯化钠中含有少量不溶的杂质,会造成实际所取的溶质的质量偏小,溶质的质量分数偏小;
溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为12%的NaCl溶液,所需氯化钠的质量为100g×12%=12g.所需水的质量为100g-12g=88g(合88mL),选取量筒时,尽量选用能一次量取的最小规格的量筒,应用100mL量筒量取88mL水.
故答案为:(1)烧杯;玻璃棒;(2)砝码与药品位置放反了;(3)偏小;③.
点评 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需的仪器是正确解答本题的关键.

练习册系列答案
相关题目
3. 某兴趣小组用如图所示装置用一氧化碳和氧化铁反应进行实验.
某兴趣小组用如图所示装置用一氧化碳和氧化铁反应进行实验.
(1)实验进行一段时间后,硬质玻璃管中的固体由红棕色变成黑色且能被磁铁吸引,右边试管中出现白色浑浊,形成该白色浑浊的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)为确定硬质玻璃管中最后得到的黑色物质的成分,兴趣小组查阅了相关资料,发现用CO还原Fe2O3炼铁的过程大致分为下列三个阶段:
阶段1:3Fe2O3+CO$\frac{\underline{\;500-600℃\;}}{\;}$2Fe3O4+CO2
阶段2:Fe3O4+CO$\frac{\underline{\;600-700℃\;}}{\;}$3FeO+CO2
阶段3:FeO+CO$\frac{\underline{\;700℃\;}}{\;}$Fe+CO2
铁粉及其氧化物的部分性质如表所示:
据此兴趣小组认为该黑色固体的组成可能有多种情况,可能是纯净的Fe3O4、纯净的Fe、由Fe2O3和Fe3O4组成的混合物,还有可能是FeO、Fe3O4;Fe、FeO(有几种情况就写几种,不同
种情况之间用分号分开,否则视为一种情况).
 某兴趣小组用如图所示装置用一氧化碳和氧化铁反应进行实验.
某兴趣小组用如图所示装置用一氧化碳和氧化铁反应进行实验.(1)实验进行一段时间后,硬质玻璃管中的固体由红棕色变成黑色且能被磁铁吸引,右边试管中出现白色浑浊,形成该白色浑浊的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)为确定硬质玻璃管中最后得到的黑色物质的成分,兴趣小组查阅了相关资料,发现用CO还原Fe2O3炼铁的过程大致分为下列三个阶段:
阶段1:3Fe2O3+CO$\frac{\underline{\;500-600℃\;}}{\;}$2Fe3O4+CO2
阶段2:Fe3O4+CO$\frac{\underline{\;600-700℃\;}}{\;}$3FeO+CO2
阶段3:FeO+CO$\frac{\underline{\;700℃\;}}{\;}$Fe+CO2
铁粉及其氧化物的部分性质如表所示:
| 铁及铁的氧化物 | Fe粉 | FeO | Fe2O3 | Fe3O4 |
| 颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
种情况之间用分号分开,否则视为一种情况).
17.往稀硫酸中加入下列固体物质后,不能使pH显著提高的是( )
| A. | 氯化钠 | B. | 氢氧化钠 | C. | 锌粒 | D. | 氧化钙 |
16.除去下列物质中的少量杂质(括号内杂质)的方法,合理的是( )
| A. | CaO(CaCO3):加入足量的稀盐酸 | |
| B. | CO2(CO):在氧气中点燃 | |
| C. | H2(HCl、H2O):将混合气体通过NaOH固体 | |
| D. | KNO3(K2SO4):溶解,加入过量的BaCl2溶液,过滤 |
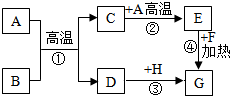 A-H是初中化学常见的物质.已知A为黑色固体物质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示,请回答:
A-H是初中化学常见的物质.已知A为黑色固体物质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示,请回答: