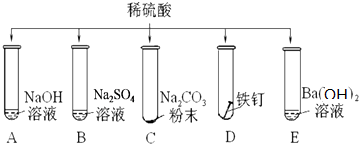
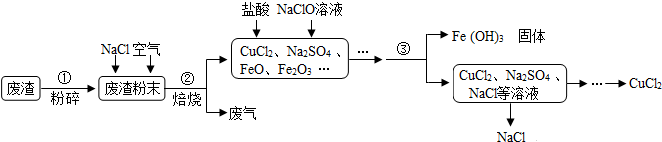
题目内容
12.a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )
| A. | 将t1℃时b 的饱和溶液升温到t2℃,溶液质量不变 | |
| B. | 将t2℃时a 的饱和溶液降温至t1℃,溶液质量减小 | |
| C. | t2℃时,两种物质的溶液中溶质的质量分数a 一定大于b | |
| D. | t2℃时,两种物质的饱和溶液分别降温至t1℃,两溶液溶质的质量分数相等 |
分析 根据题目信息和溶解度曲线可知:a、b种固体物质的溶解度,都是随温度升高而增大,而a的溶解度随温度的升高变化比b大;将t1℃时b 的饱和溶液升温到t2℃,溶液质量不变正确,只是由饱和变为不饱和;将t2℃时a 的饱和溶液降温至t1℃,溶液质量减小正确,因为有晶体析出;t2℃时,两种物质的溶液中溶质的质量分数a 一定大于b错误,因为没有指明是饱和溶液;t2℃时,两种物质的饱和溶液分别降温至t1℃,两溶液溶质的质量分数相等正确,因为降温后,它们的溶解度相等.
解答 解:A、将t1℃时b 的饱和溶液升温到t2℃,溶液质量不变正确,只是由饱和变为不饱和,正确但不符合题意,故选项错误;
B、将t2℃时a 的饱和溶液降温至t1℃,溶液质量减小正确,因为有晶体析出,正确但不符合题意,故选项错误;
C、t2℃时,两种物质的溶液中溶质的质量分数a 一定大于b错误,因为没有指明是饱和溶液,错误符合题意,故选项正确;
D、t2℃时,两种物质的饱和溶液分别降温至t1℃,两溶液溶质的质量分数相等正确,因为降温后,它们的溶解度相等,正确但不符合题意,故选项错误;
故选C
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液溶质质量分数的变化等,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
8. 红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】甲同学的方案:
【实验质疑】
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙.
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
【实验探究2】
乙、丙同学设计如下实验方案继续验证:

(1)③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)乙、丙同学实验中能得出固体样品中一定还含有,仍有一种物质不能确定,该物质是Ca(OH)2.
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.
【实验结论】综合上述实验及所给数据,久置固体的成分是Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
 红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】甲同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有 和Ca(OH)2. |
| (2)另取少量固体放于试管中,滴加足量的 | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 | 固体中一定含有CaCO3 |
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙.
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
【实验探究2】
乙、丙同学设计如下实验方案继续验证:

(1)③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)乙、丙同学实验中能得出固体样品中一定还含有,仍有一种物质不能确定,该物质是Ca(OH)2.
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.
【实验结论】综合上述实验及所给数据,久置固体的成分是Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
17. 如图为一个化学反应的微观示意图,其中“●”表示H原子,“”表示Cl原子,下列有关说法中正确的是( )
如图为一个化学反应的微观示意图,其中“●”表示H原子,“”表示Cl原子,下列有关说法中正确的是( )
 如图为一个化学反应的微观示意图,其中“●”表示H原子,“”表示Cl原子,下列有关说法中正确的是( )
如图为一个化学反应的微观示意图,其中“●”表示H原子,“”表示Cl原子,下列有关说法中正确的是( )| A. | “ ”表示氢分子 ”表示氢分子 | B. | 反应前后分子种类不变 | ||
| C. | 反应涉及二种单质和二种化合物 | D. | 反应可表示为:H2+Cl2=HCl |
 A~F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去).
A~F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去).