题目内容
小宇用配制的10%的CuSO4溶液测定一瓶NaOH溶液中溶质的质量分数.
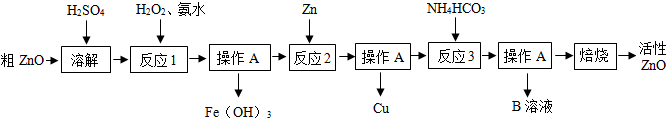
(1)下图是配制CuSO4溶液的操作过程,正确的顺序是 (填序号).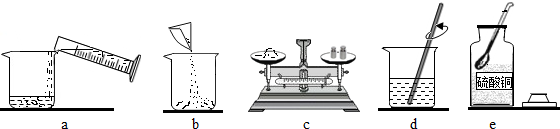
(2)取NaOH溶液25g,向其中加入10%的CuSO4溶液40g时恰好完全反应.计算NaOH溶液中溶质的质量分数.
(1)下图是配制CuSO4溶液的操作过程,正确的顺序是

(2)取NaOH溶液25g,向其中加入10%的CuSO4溶液40g时恰好完全反应.计算NaOH溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,一定溶质质量分数的溶液的配制,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算,有关溶液溶质质量分数的计算
分析:(1)根据配制溶液的一般步骤可以完成解答;
(2)氢氧化钠和硫酸铜溶液反应生成了硫酸钠和氢氧化铜承担,可以据此写出该反应的化学方程式,结合硫酸铜的质量计算出氢氧化钠的质量,进而求出氢氧化钠溶液中溶质的质量分数即可.
(2)氢氧化钠和硫酸铜溶液反应生成了硫酸钠和氢氧化铜承担,可以据此写出该反应的化学方程式,结合硫酸铜的质量计算出氢氧化钠的质量,进而求出氢氧化钠溶液中溶质的质量分数即可.
解答:解:(1)配制硫酸铜溶液时,计算完后,进行称量,称量时先称固体盐,后量取水,最后是溶解,故步骤为:称量、量取、溶解.结合图示正确的操作顺序是e c b a d.
(2)CuSO4溶液中所含CuSO4质量为:40g×10%=4g
设氢氧化钠溶液中氢氧化钠的质量为x
CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
160 80
4g x
=
解得:x=2g
氢氧化钠溶液中溶质的质量分数=
×100%=8%
答:NaOH溶液中溶质的质量分数为8%.
答案:(1)e c b a d;
(2)8%.
(2)CuSO4溶液中所含CuSO4质量为:40g×10%=4g
设氢氧化钠溶液中氢氧化钠的质量为x
CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
160 80
4g x
| 160 |
| 4g |
| 80 |
| x |
解得:x=2g
氢氧化钠溶液中溶质的质量分数=
| 2g |
| 25g |
答:NaOH溶液中溶质的质量分数为8%.
答案:(1)e c b a d;
(2)8%.
点评:本题考查根据化学方程式的相关计算,注意带入方程式计算的必须是实际参加反应的物质的量或实际生成的物质的量;根据质量守恒定律,参加反应的物质总质量等于生成的物质总质量.

练习册系列答案
相关题目
“我思故我在”,某同学反思总结了以下知识点:
①用肥皂水能区分软水和硬水;
②只有化学反应中的燃烧才能放出热量;
③农业上可以用熟石灰改良酸性土壤;
④核外电子总数为10的中性粒子一定是He原子(He元素的原子序数为10);
⑤全棉棉线燃烧时能闻到烧焦羽毛气味;
⑥保护金属资源的有效途径是防止金属腐蚀,回收利用废旧金属,合理有效地开采矿物,以及寻找金属的代用品等,其中正确的是( )
①用肥皂水能区分软水和硬水;
②只有化学反应中的燃烧才能放出热量;
③农业上可以用熟石灰改良酸性土壤;
④核外电子总数为10的中性粒子一定是He原子(He元素的原子序数为10);
⑤全棉棉线燃烧时能闻到烧焦羽毛气味;
⑥保护金属资源的有效途径是防止金属腐蚀,回收利用废旧金属,合理有效地开采矿物,以及寻找金属的代用品等,其中正确的是( )
| A、①②④ | B、①③④ |
| C、①③⑥ | D、②⑤⑥ |
健康对每一个人都很重要,下列有关人体健康的说法正确的是( )
①碳、氢、氧三种元素都已无机盐形式存在
②肉类、豆类中富含锌、铁等微量元素
③经常不吃早餐的人,容易血液中葡萄糖含量过低,而导致血糖过低
④摄入食盐中的氯离子可以在胃液中起到促生胃酸,增进食欲,帮助消化的作用
⑤钠离子和钾离子对于维持人体体液恒定的pH有重要的作用.
①碳、氢、氧三种元素都已无机盐形式存在
②肉类、豆类中富含锌、铁等微量元素
③经常不吃早餐的人,容易血液中葡萄糖含量过低,而导致血糖过低
④摄入食盐中的氯离子可以在胃液中起到促生胃酸,增进食欲,帮助消化的作用
⑤钠离子和钾离子对于维持人体体液恒定的pH有重要的作用.
| A、②④⑤ | B、②③④⑤ |
| C、②③⑤ | D、①②③④⑤ |
下列物质中,属于纯净物的是( )
| A、洁净的空气 | B、合金 |
| C、液态氧 | D、水泥砂浆 |
 下面是利用如图装置完成验证二氧化碳性质的实验.
下面是利用如图装置完成验证二氧化碳性质的实验.