题目内容
9.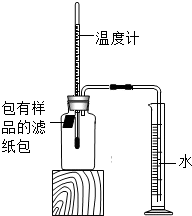 某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:
某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:| 序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
| ① | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| ② | 1g铁粉、0.2g碳和10滴水和少量NaCl | 100 | 70 | 约70 |
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热 (填“放热”或“吸热”)过程.
(3)若欲探究碳对铁锈蚀速率的影响,应选择的药品有1g铁粉和10滴水(或1g铁粉、10滴水和少量氯化钠).
(4)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气体积分数的计算式为(100-70)ml/150ml×100%.
分析 (1)对实验①和②的数据进行比较,即可得出NaCl可以加快铁锈蚀的速率;
(2)根据信息“实验开始后,广口瓶内温度有所上升”进行分析;
(3)从探究实验中,对照试验组之间只能有一个变量,从而根据唯一变量所出现的不同结果,得出科学的结论.分析表中数据,根据唯一变量是碳,得出碳对铁生锈的影响;
(4)通过空气体积的变化得出,空气中氧气的体积分数.
解答 解:(1)实验①和②之间唯一的变量为是NaCl,根据含有NaCl的实验②,反应所需的时间较短,得到NaCl能加快铁锈蚀的速率;
(2)根据信息“实验开始后,广口瓶内温度有所上升”,可以直接得出铁锈蚀的过程是放热的过程;
(3)实验是探究碳对铁锈蚀速率的影响,所以该对照组间唯一的变量应为是否含有碳,因为实验①有碳,则对照实验中不含碳,而其它的因素应完全相同,所以对照实验的样品组成为1g铁粉、10滴水,如果与实验②形成对照,则对照实验的样品组成为1g铁粉、10滴水和少量氯化钠;故填:1g铁粉和10滴水(或1g铁粉、10滴水和少量氯化钠);
(4)因为量筒内液体减少的体积即为广口瓶内所含有的全部氧气的体积,所以氧气的体积含量是$\frac{(100-70)ml}{150ml}$×100%.
故答案为:(1)加快;
(2)放热;
(3)1g铁粉和10滴水(或1g铁粉、10滴水和少量氯化钠);
(4)$\frac{(100-70)ml}{150ml}$×100%.
点评 本题考查学生根据铁生锈的条件和防止金属的腐蚀的方法进行分析解题,并将知识应用到生活中去.

练习册系列答案
相关题目
10.下列图象中,能正确反映其对应变化关系的是( )
| A. | 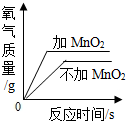 加热等质量的氯酸钾制取氧气 | B. | 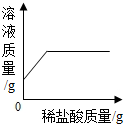 向一定质量的烧碱溶液中加稀盐酸 | ||
| C. | 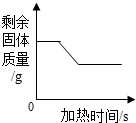 实验室高温加热一定质量的石灰石 | D. | 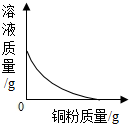 向一定质量的硝酸银溶液中加铜粉 |
4.夏天到了,衣服上常会留下难以清洗的汗渍,果汁渍等.某校“我与化学”兴趣小组对“污渍爆炸盐”(一种新型衣物助洗剂)化学成分进行探究.主要探究过程如下:
(1)阅读产品标签:“主要成分是过氧碳酸钠,能在瞬间去除洗衣粉难以除去的多重顽固污渍…,本产品不伤衣物,‘无磷’是它的一大优点”.含磷洗涤剂对环境的危害是导致水体富营养化,产生水华现象.
(2)查阅资料:过氧碳酸钠(Na2CO4),白色结晶颗粒,其溶于水会产生碳酸盐和其他化合物.
(3)合理猜想:①其化合物为NaOH;②其化合物为H2O2;③其化合物为NaOH 和H2O2;该小组同学做出以上猜想的理论依据是根据质量守恒定律,化学反应前后元素的种类不变.
(4)实验设计:探究“污渍爆炸盐”水溶液的成份,完成下列表格.
限选试剂:稀盐酸、BaCl2 溶液、MgCl2 溶液、MnO2、蒸馏水
(1)阅读产品标签:“主要成分是过氧碳酸钠,能在瞬间去除洗衣粉难以除去的多重顽固污渍…,本产品不伤衣物,‘无磷’是它的一大优点”.含磷洗涤剂对环境的危害是导致水体富营养化,产生水华现象.
(2)查阅资料:过氧碳酸钠(Na2CO4),白色结晶颗粒,其溶于水会产生碳酸盐和其他化合物.
(3)合理猜想:①其化合物为NaOH;②其化合物为H2O2;③其化合物为NaOH 和H2O2;该小组同学做出以上猜想的理论依据是根据质量守恒定律,化学反应前后元素的种类不变.
(4)实验设计:探究“污渍爆炸盐”水溶液的成份,完成下列表格.
限选试剂:稀盐酸、BaCl2 溶液、MgCl2 溶液、MnO2、蒸馏水
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌 | 固体完全溶解,形成无色溶液 |  |
| 步骤2:取少量步骤1形成的溶液与试管中,再滴加过量BaCl2溶液,震荡,静置 | 产生白色沉淀 | 含有Na2CO3 |
| 步骤3:取少量步骤2试管中的上层溶液与另一支试管中,再滴加少量MgCI2溶液,震荡 | 无明显现象 | 不含NaOH |
| 步骤4:另取一支试管,加入少量步骤1形成的溶液,再加入少量MnO2,将带火星木条伸入试管中 | 溶液中有气泡产生,带火星木条复燃 | 含有H2O2 |
14.下列化肥中不属于氮肥的是( )
| A. | NH4HCO3 | B. | CO(NH2)2 | C. | NaNO3 | D. | KCl |
1.下列实验操作错误的是( )
| A. |  取用固体 | B. |  滴加液体 | C. |  点燃酒精灯 | D. |  称量固体 |
18.下列物质溶于水后能形成无色溶液的是( )
| A. | 硫酸铜 | B. | 食盐 | C. | 柴油 | D. | 面粉 |
 甲、乙、丙三种固体物质的溶解度曲线如图所示.回答下列问题:
甲、乙、丙三种固体物质的溶解度曲线如图所示.回答下列问题:
 ,②所示元素的单质的化学式是Cl2
,②所示元素的单质的化学式是Cl2 如图为实验室中一瓶标签残缺的稀盐酸.张岩同学为了测定稀盐酸中溶质的质量分数,从瓶中取出10g稀盐酸倒入烧杯中,然后往烧杯中逐滴加入溶质的质量分数为10%氢氧化钠溶液,当测得烧杯中溶液的pH=7时共用去氢氧化钠溶液8g.
如图为实验室中一瓶标签残缺的稀盐酸.张岩同学为了测定稀盐酸中溶质的质量分数,从瓶中取出10g稀盐酸倒入烧杯中,然后往烧杯中逐滴加入溶质的质量分数为10%氢氧化钠溶液,当测得烧杯中溶液的pH=7时共用去氢氧化钠溶液8g.