题目内容
12.氢氧化钙俗称熟石灰、消石灰,水溶液是石灰水,有腐蚀性.把一瓶石灰水放到空气中,瓶壁和表面有一层白色物质,形成原因是(用方程式表示)Ca(OH)2+CO2=CaCO3↓+H2O.分析 根据氢氧化钙的性质进行分析,氢氧化钙俗称熟石灰或消石灰,微溶于水,能与二氧化碳反应生成碳酸钙沉淀和水解答.
解答 解:氢氧化钙俗称熟石灰或消石灰,微溶于水,能与空气中的二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
答案:熟石灰;消石灰;Ca(OH)2+CO2=CaCO3↓+H2O.
点评 本题考查了氢氧化钙的有关性质和用途,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
3.钢铁工业是国家工业的基础.某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识.请你回答千列社会实践活动小组感兴趣的问题:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石1.97吨(结果保留两位小数).
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到lg白色沉淀.
①计算此钢样粉末中铁和碳的质量之比.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如了表所示(标准状况下,2g H2的体积为22.4L):
请根据表中数据计算稀硫酸中H2SO4的质量分数.
③若在实验Ⅱ中继续加入mg钢样粉末,请用含m的代数式表示反应结束后剩余的全部固体质量为(只写出最后结果即可)当m>1.406g,剩余固体质量为:(m-1.376)g;
当m≤1.406g,剩余固体质量为:(5.624+m)×$\frac{0.12g}{28.12g}$g.
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石1.97吨(结果保留两位小数).
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到lg白色沉淀.
①计算此钢样粉末中铁和碳的质量之比.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如了表所示(标准状况下,2g H2的体积为22.4L):
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢禅的粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/g(标况下) | 1.120 | 2.240 | 2.800 |
③若在实验Ⅱ中继续加入mg钢样粉末,请用含m的代数式表示反应结束后剩余的全部固体质量为(只写出最后结果即可)当m>1.406g,剩余固体质量为:(m-1.376)g;
当m≤1.406g,剩余固体质量为:(5.624+m)×$\frac{0.12g}{28.12g}$g.
20.在实验室用CO还原赤铁矿(主要成分是Fe2O3),下面说法不正确的是( )
| A. | 实验开始前要先通入CO,再加热 | |
| B. | 实验过程中观察到玻璃管内红色粉末逐渐变黑,澄清石灰水变浑浊 | |
| C. | 实验结束后要先停止通入CO,再停止加热 | |
| D. | CO具有还原性,H2、C也具有还原性 |
7.有四种溶液,分别是盐酸、硫酸铜溶液、氯化铁溶液、无色酚酞试液,用一种试剂就可以将它们区别开来,应选用的试剂是( )
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | BaCl2 |
17.某物质具有如下性质,滴入无色酚酞变红,滴入氯化铜产生蓝色沉淀,加入碳酸钠溶液产生白色沉淀,则该物质是( )
| A. | KOH | B. | Mg(OH)2 | C. | CuSO4 | D. | Ca(OH)2 |
4.下列各组物质中能相互反应且属于复分解反应的是( )
| A. | 氢氧化镁和稀盐酸 | B. | 二氧化碳和石灰水 | ||
| C. | 氯化钾溶液和硝酸钠溶液 | D. | 锌和硫酸 |
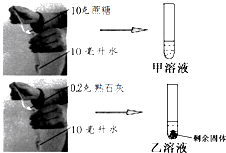 小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知:
小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知: