题目内容
8.物质除杂是化学实验中经常遇到的问题.【方法探究】为了除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案.
| 实验方案 | |
| 方案A |  |
| 方案B | 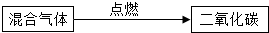 |
| 方案C | 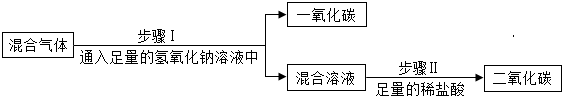 |
【方法提炼】上述两种合理方案体现了物质除杂的不同思路:
思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,在将中间物质转化为所需物质.
【方法运用】
运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的硫酸镁溶液,过滤、蒸发,即得氯化镁固体.
运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾.
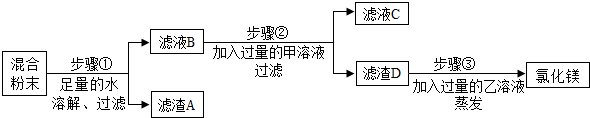
步骤①中反应的化学方程式是BaCl2+K2SO4═BaSO4↓+2KCl,滤液B中一定含有的溶质是氯化钾、氯化钠、氯化镁;
步骤②中反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl,滤液C中一定含有的阴离子是氯离子和氢氧根离子;
步骤③中乙溶液是HCl(填化学式)溶液.
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:【方法探究】一氧化碳与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故所采取的方法错误.
CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,碳酸钠溶液与稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑.
【方法运用】运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的硫酸镁溶液,氯化钡与硫酸镁溶液反应生成硫酸钡沉淀和氯化镁,过滤、蒸发,即得氯化镁固体.
运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾,加入足量的水溶解后,硫酸钾能与氯化钡溶液反应生成硫酸钡沉淀和氯化钾,步骤①中反应的化学方程式是BaCl2+K2SO4═BaSO4↓+2KCl;滤液B中一定含有的溶质是氯化钾、氯化钠、氯化镁.
向滤液中加入过量的氢氧化钠溶液,氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl;滤液C中一定含有的溶质是氯化钠、氯化钾、氢氧化钠,一定含有的阴离子是氯离子和氢氧根离子.
滤渣D为氢氧化镁,与过量的稀盐酸(HCl)反应生成氯化镁和水,再蒸发,即得到氯化镁溶液.
故答案为:【方法探究】CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2(或CO2+2NaOH═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑);
【方法运用】硫酸镁;BaCl2+K2SO4═BaSO4↓+2KCl;氯化钾、氯化钠、氯化镁;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;氯离子和氢氧根离子;HCl.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

| A. | 证明O2中混有少量CO2-将燃着的木条伸入集气瓶中观察是否熄灭 | |
| B. | 证明CaCl2粉末中混有CaCO3-取样,滴入稀盐酸观察是否有气泡产生 | |
| C. | 除去炭粉中混有的氧化铜-将固体粉末在空气中灼烧 | |
| D. | 除去N2中混有的CO2、CO-将混合气体依次通过澄清的石灰水、灼热的CuO |
【查阅资料】将纯碱,食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后即得到料液.写出料液制作过程中发生反应的化学方程式CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【提出问题】料液中除含有NaOH和NaCl外,还含有那些溶质?
【猜想假设】甲:只有Ca(OH)2,乙:只有Na2CO3,丙:既有Ca(OH)2,也有Na2CO3;
上述猜测中,肯定错误的是丙,理由是碳酸钠和氢氧化钙不能共存.
| 实验步骤 | 实验现象 |
| ①取少量上层料液过滤,取滤液滴加一定量稀盐酸 | 产生大量气泡 |
| ②另取少量滤液,滴加碳酸钠溶液 | 无明显现象 |
【得出结论】同学乙(填“甲”或“乙”)的结论是正确的.
【反思提升】丁同学取一定量的滤液于试管中,向其中滴加少量稀盐酸,却没有看到气泡产生,你认为可能的原因是稀盐酸先和氢氧化钠反应.
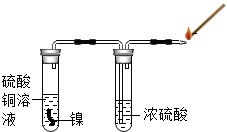 某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.探究活动一、金属镍和铜的活动性顺序
| 实验方案 | 实验现象 | 实验结论 |
| 将金属镍加入到盛有硫酸铜溶液的试管中 | 溶液的颜色变浅,有红色固体析出 | 镍比铜的金属活动性强 |
实验过程中,小组同学还发现试管中有无色气体产生的“异常”现象,十分好奇,于是继续进行探究活动.
探究活动二、无色气体的成分是什么?
【猜想假设】A.氢气 B.氧气 C.二氧化硫 D.二氧化碳 E.一氧化碳
【分析推理】小明认为无色气体不可能是二氧化碳或一氧化碳,理由是反应物中不含碳元素,化学反应前后元素种类不变.
小红根据二氧化硫能够形成酸雨的事实,推测二氧化硫能溶于水,且水溶液应该呈酸性能使指示剂变色小组同学认为小红的观点合理,于是将收集到到气体收入紫色石蕊溶液溶液中,发现溶液不变色,证明无色气体不是二氧化硫.
综上所述,小组同学认为,无色气体可能是氢气,或者氧气.
【设计方案】为确定气体成分,小组同学设计了如下实验方案:
用如图所示装置进行实验,先检验气体纯度,然后将燃着的木条放在尖嘴处,发现气体燃烧并发出淡蓝色火焰,证明无色气体可能是氢气.
该实验方案中浓硫酸的作用是除去气体中的水分.
【评价与反应】小组同学认为,还可以补充一个实验,验证无色气体中含有氢元素,从而进一步证明无色气体可能是氢气.他们应补充的实验是在点燃气体的火焰上方罩一个干冷的烧杯,烧杯内壁产生水珠.
| 选项 | 事实 | 解释 |
| A | 浓氨水敞口放置浓度会变稀 | 分子是不断运动的 |
| B | 金属铁的热胀冷缩 | 温度高时原子变大,降温时变小 |
| C | 二氧化碳无毒,而一氧化碳有毒 | 物质组成元素相同,但分子结构不同 |
| D | 稀硫酸能导电 | 溶液中有可自由移动的离子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用干冰冷藏的食品 | B. | 牛奶中添加氧化钙以补充钙质 | ||
| C. | 用甲醛浸泡的海鲜 | D. | 用工业用盐腌制的肉类食品 |
| A. | 氯化钠 | B. | 氧化钙 | C. | 氢氧化钙 | D. | 氢氧化钠 |