题目内容
1.汽车是生活中重要的交通工具.(1)汽车制造需要大量的钢铁.工业上用一氧化碳和赤铁矿(主要成分是Fe2O3)炼铁,发生反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
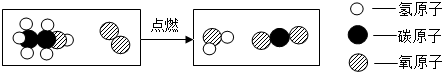
(2)乙醇是一种清洁的燃料,乙醇汽油可以减少汽车尾气造成的污染.乙醇燃烧反应的微粒示意图如下.反应中,生成水和二氧化碳的质量比为27:44.
分析 (1)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳;
(2)根据微观示意图写出化学方程式并根据化学方程式的意义进行解答.
解答 解:(1)高温条件下,氧化铁和一氧化碳反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)由示意图可知,乙醇燃烧的化学方程式为:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;反应中生成的水和二氧化碳的质量比
为:3×(1×2+16):2×(12+16×2)=27:44;故填:27:44.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力和根据化学方程式的意义,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
11.向盛有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如表.请分析并回答下列问题:
(1)当加入氢氧化钠溶液的体积为10mL时,稀盐酸和氢氧化钠溶液恰好完全反应;
(2)当加入氢氧化钠溶液的体积为13mL时,溶液显蓝色.
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
(2)当加入氢氧化钠溶液的体积为13mL时,溶液显蓝色.
6. 根据如图的信息判断,下列说法正确的是( )
根据如图的信息判断,下列说法正确的是( )
 根据如图的信息判断,下列说法正确的是( )
根据如图的信息判断,下列说法正确的是( )| A. | 硫属于金属元素 | |
| B. | 硫原子的相对原子质量为32.07 g | |
| C. | 硫原子的核电荷数为16 | |
| D. | 在化学反应中,硫原子容易失去电子 |
13.下列说法中,正确的是( )
| A. | 恒温蒸发NaCl的饱和溶液溶质的质量分数变大 | |
| B. | 物理变化中分子种类不变 | |
| C. | 造成空气污染的主要气体有CO、CO2、SO2等 | |
| D. | 带电的微粒都称为离子 |
11.徐庙中学化学李老师发明了一种增氧酒精灯,将纯净的氧气通入灯芯座的增氧孔用于提高火焰的温度.普通酒精灯火焰温度为500℃左右,增氧酒精灯火焰温度可达1000℃以上.某活动小组同学取碳酸钙固体用增氧酒精灯加热1~2分钟.
【提出问题】加热后剩余固体的成分是什么?
【猜想与探究】猜想一:碳酸钙全部分解,剩余固体成分为CaO.
猜想二:碳酸钙部分分解,剩余固体成分为CaO和CaCO3.
你认为剩余固体成分还可能为全部为CaCO3.
为了验证猜想,活动小组的同学设计方案进行实验,如下表所示:
【结论】猜想二成立.
【反思与评价】你认为活动小组的同学们得出的结论有(有或没有)问题,理由是氧化钙和水反应生成的氢氧化钙微溶于水.
【拓展与分析】另取同样的碳酸钙固体用普通酒精灯加热1~2分钟,将加热后的固体放入水中,搅拌、静置.取上层清液,滴加无色酚酞试液,不变色,此时加热后的固体成分为碳酸钙,发生该情况的原因是没有达到碳酸钙分解的温度.
【提出问题】加热后剩余固体的成分是什么?
【猜想与探究】猜想一:碳酸钙全部分解,剩余固体成分为CaO.
猜想二:碳酸钙部分分解,剩余固体成分为CaO和CaCO3.
你认为剩余固体成分还可能为全部为CaCO3.
为了验证猜想,活动小组的同学设计方案进行实验,如下表所示:
| 实验步骤 | 实验现象 | 结论 | |
| 步骤A | 将加热后的固体放入水中,搅拌、静置. | 底部有大量白色不溶物 | 剩余固体中含有碳酸钙 |
| 步骤B | 取上层清液,滴加无色酚酞试液. | 变 红 | 剩余固体中含有CaO |
【反思与评价】你认为活动小组的同学们得出的结论有(有或没有)问题,理由是氧化钙和水反应生成的氢氧化钙微溶于水.
【拓展与分析】另取同样的碳酸钙固体用普通酒精灯加热1~2分钟,将加热后的固体放入水中,搅拌、静置.取上层清液,滴加无色酚酞试液,不变色,此时加热后的固体成分为碳酸钙,发生该情况的原因是没有达到碳酸钙分解的温度.

