题目内容
10. 过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包邮过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时发现棉花燃烧起来.
过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包邮过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时发现棉花燃烧起来.(1)实验中:位于下面的蜡烛先熄灭,上面的后熄灭.这一现象说明二氧化碳具有二氧化碳密度大于空气密度,不燃烧也不支持燃烧性质.
(2)棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了满足“棉花是可燃物”这一条件,还需要满足的条件是氧气和温度、达到棉花的着火点.
提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:在常温下Na2O2和CO2能发生化学反应.
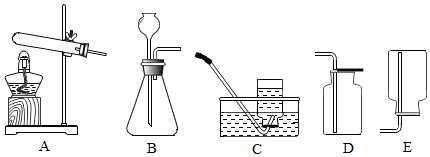
设计实验:经过讨论后,小组同学利用如图所示的实验装置进行探究.要使Na2O2与CO2反应,实验装置中导管口正确的链接顺序是adeb.

实验步骤:①按以上顺序装好装置,并检查其气密性,添加药品;
②推动注射器,并将稀盐酸注入锥形瓶中;
③一段时间后,在尾气处放置一根带火星的小木条,观察现象.
实验现象:带火星的小木条复燃且饱和澄清石灰水变浑浊.
实验分析:①浓硫酸的作用是除去CO2中的水蒸气;
②烧杯内变浑浊的原因是温度升高,氢氧化钙的溶解度减小,溶质析出.
实验结论:①“小木条复燃”说明了Na2O2和CO2反应产生了氧气;
②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应放出(填“吸收”或“放出”)热量,使棉花满足了燃烧条件.
(3)已知Na2O2和CO2反应生成上述气体的同时还有纯碱生成.欲产生16g氧气,至少需要过氧化钠的质量为多少?
分析 二氧化碳具有密度比空气大且既不燃烧也不支持燃烧的性质,常用作灭火剂,燃烧的条件是有可燃物,与氧气接触,温度达到可燃物的着火点,要使Na2O2与CO2反应,须除去产生的二氧化碳中的水蒸气,以防造成干扰,浓硫酸具有吸水性,可以用作干燥剂,过氧化钠能与二氧化碳反应放出热量,使温度升高,氢氧化钙的溶解度随温度的升高而减小,会析出氢氧化钙固体而使溶液变浑浊,过氧化钠能与二氧化碳反应生成碳酸钠和氧气,根据氧气的质量可以求得需要过氧化钠的质量.
解答 解:
(1)位于下面的蜡烛先熄灭,上面的后熄灭.说明具有密度比空气大且既不燃烧也不支持燃烧的性质,所以本题答案为:二氧化碳密度大于空气密度,不燃烧也不支持燃烧;
(2)燃烧的条件是有可燃物,与氧气接触,温度达到可燃物的着火点,所以本题答案为:氧气和温度、达到棉花的着火点;
要使Na2O2与CO2反应,须除去产生的二氧化碳中的水蒸气,以防造成干扰,使用浓硫酸干燥二氧化碳气体时,需使气体从长管进入干燥瓶,从短管逸出,所以本题答案为:adeb;
浓硫酸具有吸水性,可以用作干燥剂,用于除水,所以本题答案为:除去CO2中的水蒸气;
过氧化钠能与二氧化碳反应放出热量,使温度升高,氢氧化钙的溶解度随温度的升高而减小,会析出氢氧化钙固体而使溶液变浑浊,所以本题答案为:温度升高,氢氧化钙的溶解度减小,溶质析出;
“小木条复燃”说明了Na2O2和CO2反应产生了氧气,所以本题答案为:氧气;
“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应放出了热量(注意此处强调的是饱和溶液的浑浊,应该考虑这种特殊物质的溶解性变化趋势),所以本题答案为:放出;
(3)设需要过氧化钠的质量为x,则有
2Na2O2+2CO2═2Na2CO3+O2↑
156 32
x 16g
$\frac{156}{x}=\frac{32}{16g}$
x=78g.
答:需要过氧化钠的质量为78g.
点评 本题探究了过氧化钠与二氧化碳反应的有关知识,完成此题,需要从题干叙述中抽取有用的信息,然后进行解题.

| A. |  如图表示水通电分解产生的气体质量m与反应时间t的关系 | |
| B. |  如图表示两份完全相同的双氧水在有无MnO2的情况下,产生的O2的质量与反应时间t的关系 | |
| C. |  如图表示往锌中加入足量的稀H2SO4,产生的H2的质量m与反应时间t的关系 | |
| D. |  如图表示往稀盐酸和CuCl2混合液中滴入NaOH溶液,产生的沉淀质量与加NaOH溶液质量关系 |
| A. | 硫酸钾(K2SO4 ) | B. | 磷矿粉[有效成分Ca3(PO4)2] | ||
| C. | 磷酸二氢钾(KH2PO4 ) | D. | 尿素[CO(NH2)2] |
【提出猜想】
猜想1:HCl和BaCl2
猜想2:HCl、Ba(OH)2和BaCl2
猜想3:只有BaCl2
你的猜想是Ba(OH)2和BaCl2(填化学式)
上述猜想中,你认为不合理的猜想是猜想2;原因是2HCl+Ba(OH)2=BaCl2+2H2O(用化学方程式表示).
【查阅资料】BaCl2溶液呈中性
【实验设计】依据上述猜想,实验小组同学分别设计了如表方案.
| 实验步骤 | 预期实验现象 | 结论 |
| a.取少量烧杯内的溶液与试管中,滴加无色酚酞试液 | 无明显变化 | 猜想3正确 |
| b.另取少量烧杯内的溶液于试管中,滴加足量的碳酸钠溶液 | 先有气泡产生,再有白色沉淀产生. | 猜想1成立 |
(1)小王同学提出,上述实验过程中步骤a所得出的结论不正确,原因是稀盐酸显酸性,不能使酚酞试液变色.
(2)为了证明你的猜想是否正确,除了使用酸碱指示剂外,请再设计一个实验方案:
| 实验步骤 | 实验现象 |
| 取少量烧杯内的溶液于试管中,滴加适量的氯化铜溶液 | 不产生沉淀 |
利用pH试纸,方法是:利用玻璃棒蘸取烧杯中的溶液,滴在pH试纸上,与标准比色卡对照,pH=7,溶液中不含有氢氧化钡.
 实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数.现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示.分析并计算:
实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数.现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示.分析并计算: 归纳总结是学习化学的一种方法.
归纳总结是学习化学的一种方法.