题目内容
16.在空气中点燃镁条,镁不但能与氧气反应生成氧化镁,也会与氮气反应生成氮化镁(Mg3N2).某学习小组拟对镁在空气中燃烧后的固体混合物中氮化镁的质量分数进行测定,设计如下实验装置,并进行实验探究: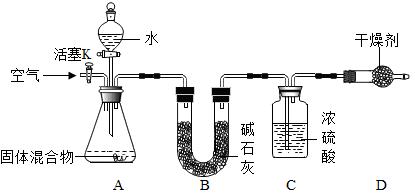
【查阅资料】
I.氮化镁与水反应生成氢氧化镁和氨气;
II.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与NH3反应;
III.2NH3+H2SO4═(NH4)2SO4
Ⅳ.NH3 是一种极易溶于水的气体.
【实验步骤】
①检查装置的气密性;
②精确称量镁在空气中燃烧后的固体5.00g 放入锥形瓶中,称量装置C,连接好装置;
③关闭活塞K,打开A 中分液漏斗活塞,逐滴加入水,至样品恰好完全反应;
④打开活塞K,鼓入空气;⑤再次称量装置C.
请你与他们一起完成下列问题的探究:
(1)检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手手掌紧贴锥形瓶外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)装置B和装置D的共同作用是吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)实验步骤④鼓入空气的作用是使产生的氨气全部进入C瓶被浓硫酸吸收;
(4)若装置C 增重0.34g,固体混合物中Mg3N2的质量分数为20%;
(5)实验证明此方法测定的结果偏低,可能原因是部分氨气溶于水中不能完全排出(写一条).
分析 检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手紧握锥形瓶的外壁,观察C瓶中有气泡产生,说明该装置不漏气;本题能使同学们体会到实验探究的一般过程,通过实验分析可知:装置B和装置D的共同作用是,吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;实验步骤④鼓入空气的作用是:使产生的氨气全部进入C瓶被浓硫酸吸收;实验证明此方法测定的结果偏低,可能原因是:部分氨气溶于水中不能完全排出.有关化学方程式的计算要准确.
解答 解:(1)检查该装置气密性的方法及现象是:关闭活塞K及分液漏斗活塞,双手紧握锥形瓶的外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)装置B和装置D的共同作用是,吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)实验步骤④鼓入空气的作用是:使产生的氨气全部进入C瓶被浓硫酸吸收;
(4)设氮化镁的质量分数为x,
Mg3N2+6H20=3Mg(OH)2↓+2NH3↑
100 34
5g•x 0.34g
$\frac{100}{5g×x}$=$\frac{34}{0.34g}$
x=20%
(5)实验证明此方法测定的结果偏低,可能原因是:部分氨气溶于水中不能完全排出.
故答案为:(1)关闭活塞K及分液漏斗活塞,双手手掌紧贴锥形瓶外壁,观察C瓶中有气泡产生,说明该装置不漏气;
(2)吸收水分,防止装置中气体中的水分和空气中的水分进入C瓶;
(3)使产生的氨气全部进入C瓶被浓硫酸吸收;
(4)20%;
(5)部分氨气溶于水中不能完全排出.
点评 实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

| 选项 | 化学规律 | 示例 |
| A | 物质结构决定性质 | 由于碳原子排列方式不同,金刚石与石墨物理性质存在很大差异 |
| B | 现象说明微观本质 | 物体热胀冷缩现象,说明构成物质的微粒间距离发生了变化 |
| C | 性质决定物质用途 | 甲醛能使蛋白质变性,可用甲醛溶液浸泡海鲜食品来保鲜 |
| D | 性质决定鉴别方法 | 有些物质燃烧气味不同,可用灼烧闻气味区分羊毛绒和棉线 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 水分子运动速率加快 | B. | 水分子之间的间隔变大 | ||
| C. | 水分子的数目增多了 | D. | 水分子的结构没有改变 |
| A. | 稀有气体可做保护气,因为原子最外层电子层达到稳定结构 | |
| B. | 水和过氧化氢的化学性质不同,因为组成元素和分子构成不同 | |
| C. | NaOH溶于水温度升高,因为Na+、OH-扩散吸收的热量大于水合放出的热量 | |
| D. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 |
| A. |  稀释浓硫酸 | B. |  蒸发结晶 | C. |  收集气体 | D. |  测溶液pH |
 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线. A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A,B,C,D,E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质.(部分反应物、生成物及反应条件已略去)请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A,B,C,D,E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质.(部分反应物、生成物及反应条件已略去)请回答: 某化学兴趣小组设计了一组“吹气球”实验,三套装置如图:
某化学兴趣小组设计了一组“吹气球”实验,三套装置如图: