题目内容
17.实验室利用大理石(含杂质,主要成分是碳酸钙)与足量的盐酸反应制取二氧化碳,反应方程式如下;(杂质不与盐酸反应)CaCO3+2HCl═CaCl2+H2O+CO2如果制取二氧化碳4.4克,问需用含碳酸钙质量分数为96%的大理石多少克?
分析 根据制取二氧化碳的质量、大理石中碳酸钙的质量分数,根据碳酸钙与稀盐酸反应的化学方程式可以列式计算出需要大理石的质量.
解答 解:设需用含碳酸钙质量分数为96%的大理石的质量为x.
2HCl+CaCO3=CaCl2+H2O+CO2↑
100 44
96%x 4.4g
$\frac{100}{96%x}$=$\frac{44}{4.4g}$
x=10.4g
答:需用含碳酸钙质量分数为96%的大理石的质量为10.4g
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.某兴趣小组的同学用图1所示装置制取氧气,然后进一步探究有关氧气的性质.请回答:
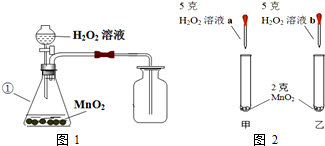
(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
(4)取34克未知浓度的双氧水与2克MnO2混合制取氧气,完全反应至质量不再减轻后,称量剩余混合物的质量为35.2克.
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.

(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
| 溶质质量分数 | 10% | 3% |
| 密度(单位g/mL) | 1.024 | 0.991 |
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.
8.掌握化学用语是学好化学的关键.下列化学用语与含义相符的是( )
| A. | 2CO-----两个一氧化碳分子 | B. | 2H----2个氢元素 | ||
| C. | O2-------2个氧原子 | D. | $\stackrel{+1}{Na}$--钠离子 |
5.下列操作中,正确的是( )
| A. |  向试管中滴加液体 | B. |  读取量筒的读数 | ||
| C. |  吹灭酒精灯 | D. |  向试管中加固体粉末 |
2.下列反应中,属于分解反应的是( )
| A. | 2Na+C12 $\frac{\underline{\;点燃\;}}{\;}$ 2NaCl | B. | 4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$ 2P2O5 | ||
| C. | 2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | CO2+Ca(OH)2═CaCO3↓+H2O |
9.在化学反应前后,下列诸项中肯定发生变化的是( )
①原子数目 ②分子种类 ③元素种类 ④物质种类 ⑤物质状态 ⑥原子种类.
①原子数目 ②分子种类 ③元素种类 ④物质种类 ⑤物质状态 ⑥原子种类.
| A. | ②④⑤ | B. | ②④ | C. | ①⑥ | D. | ①③④ |
6.类推是学习中常用的思维方法,现有以下类推结果,其中正确的是( )
| A. | 含有氧元素的物质分解可能产生氧气,能分解产生氧气的物质一定含有氧元素 | |
| B. | 置换反应一定有单质和化合物生成,有单质和化合物生成的一定是置换反应 | |
| C. | 氧化物一定含有氧元素,所以含有氧元素的物质一定是氧化物 | |
| D. | 活泼金属中滴加稀盐酸有气泡产生,滴加稀盐酸有气泡产生的物质一定是活泼金属 |
