题目内容
11.甲、乙、丙三个实验小组围绕“酸碱中和反应”在老师引导下开展探究活动,请你参与学习并帮助填写空格.【查阅资料】Na2SO4溶液呈中性
【演示实验】将一定量的稀H2SO4加入到盛有无色酚酞试液和NaOH溶液的小烧杯中.当看到溶液由红色变为无色现象,证明稀硫酸和氢氧化钠发生了化学反应.
【学生板演】该反应的化学方程式H2SO4+2NaOH═Na2SO4+2H2O.
【提出问题】部分同学产生了疑问:反应后溶液中溶质除了酚酞,还有什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验方案中有一个是错误的,错误的原因是氯化钡能与硫酸钠反应产生白色沉淀.
【反思拓展】(1)在分析反应后所得物质的成分时,除了考虑生成物,还应该考虑反应物是否过量.
(2)根据所学的化学知识,你还有哪些方法证明所得的溶液中含有硫酸,请列举一种方法中使用试剂的名称锌(合理均可).
分析 根据氢氧化钠能与硫酸反应生成硫酸钠和水以及反应物是否过量的知识进行实验猜想,根据酚酞试液在酸碱溶液中的变色知识进行分析解答;根据钡离子能与硫酸根离子结合产生硫酸钡沉淀解答即可.
解答 解:【演示实验】将一定量的稀H2SO4加入到盛有无色酚酞试液和NaOH溶液的小烧杯中.酚酞在氢氧化钠溶液中为红色,在酸性或中性溶液中为无色,故当看到溶液由红色变为无色现象,证明稀硫酸和氢氧化钠发生了化学反应.故填:溶液由红色变为无色;
【学生板演】氢氧化钠能与硫酸钠反应生成硫酸钠和水,该反应的化学方程式为H2SO4+2NaOH═Na2SO4+2H2O,故填:H2SO4+2NaOH═Na2SO4+2H2O.
【假设猜想】由于氢氧化钠会与硫酸反应,故不能同时存在,故不合理的猜想是猜想四,故填:猜想四.
【实验探究】(1)由于硫酸铜能与氢氧化钠反应产生蓝色沉淀,故丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠,故填:氢氧化钠.
【评价反思】由于氯化钡能与硫酸钠反应产生白色沉淀,故加入氯化钡产生白色沉淀的方法不能证明含有硫酸,故填:氯化钡能与硫酸钠反应产生白色沉淀.
【反思拓展】(1)在分析反应后所得物质的成分时,除了考虑生成物,还应该考虑反应物是否过量,故填:反应物是否过量.
(2)证明所得的溶液中含有硫酸,还可以利用硫酸与活泼金属的反应,使用试剂锌,故填:锌.
点评 本题考查的是常见物质成分的推断,完成此题,可以依据已有的物质的性质结合物质间反应的实验现象进行.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
9. 根据如图,天平游码的正确读数为( )
根据如图,天平游码的正确读数为( )
 根据如图,天平游码的正确读数为( )
根据如图,天平游码的正确读数为( )| A. | 1 g | B. | 2.8 g | C. | 2.6 g | D. | 3.0 g |
10.下列校园运动设施或器材中,没有用到合成材料的是( )
| A. | 钢质单杠 | B. | 塑胶跑道 | C. | 有机玻璃标示牌 | D. | 尼龙跳绳 |
7.若将100克20%的某溶液的浓度降低到5%,需加水( )
| A. | 150克 | B. | 200克 | C. | 300克 | D. | 400克 |
6.某化学兴趣小组同学在回收废旧电池的同时,开展了如下的实验探究.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:
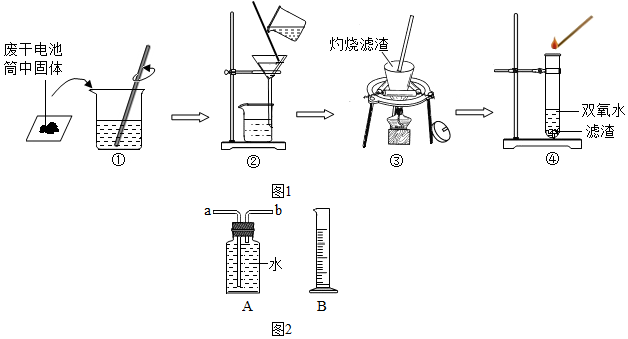
(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
[数据分析]
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.
【查阅资料】废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.
【实验1】废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用.
(2)将铜帽放入盐酸中,除去锈污,冲洗备用.
【实验2】检验废干电池筒内黑色固体中MnO2的存在
兴趣小组同学设计了如图所示的实验:

(1)操作②中过玻璃棒的作用是引流.
(2)引流操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,该反应的化学表达式为CO2.
(3)操作④试管中产生的气体能使带火星木条复燃,该气体为O2
(4)由此得出结论:滤渣中黑色固体化学式为MnO2和C
【实验3】利用回收锌皮制取氢气及相关探究
(1)用锌皮和稀硫酸制取氢气.用适当的发生装置,采用排水法收集并测定氢气的体积(如图2),气体从装置A导管口b(填“a”或“b”) 进,选用仪器B测量排出水的体积,仪器B名称是量筒.
(2)探究影响锌与稀硫酸反应快慢的因素.反应过程中用前10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表4组实验,获得数据如下.
| 实验编号 | 试剂 | 前10 min内产生的 氢气体积(mL) | |
| 锌的纯度 | 稀硫酸的体积和浓度 | ||
| a | 纯锌 | 30 mL 30% | 564.3 |
| b | 含杂质的锌 | 30 mL 30% | 634.7 |
| c | 纯锌 | 30 mL 20% | 449.3 |
| d | 纯锌 | 40 mL 30% | 602.8 |
①比较实验a和实验b得到的结论是:与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率大.
②为了研究硫酸浓度对反应快慢的影响,需比较实验a和c(填实验编号).
③探究影响该反应快慢的因素,还需控制的条件是:温度(或锌粒形状大小)(举一例即可).
【实验4】探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热.
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体.
(3)再将残留固体经溶解、过滤、洗涤、干燥、称量,得到5.5g黑色固体.
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,质量不变.
②完全反应后制得氧气的质量是9.6g.(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较产生氧气速率的大小.
20.对下列反应的化学方程式的书写及反应类型的判断都正确的是( )
| 选项 | 化学反应方程式 | 反应类型 |
| A红磷在空气中燃烧 | 4P+5O2═2P2O5 | 氧化反应 |
| B氧化铜放入稀盐酸中 | CuO+2HCl═CuCl+H2O | 复分解反应 |
| C煤炉上方产生淡蓝色火焰 | 2CO2+C$\frac{\underline{\;点燃\;}}{\;}$2CO | 化合反应 |
| D过氧化氢分解制氧气 | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | 分解反应 |
| A. | A | B. | B | C. | C | D. | D |
 A-F是我们已经学习过的六种物质,其中B、C、E通常情况下是无色气体,A、D为黑色固体,A、E为单质,F为无色液体.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应).请回答:
A-F是我们已经学习过的六种物质,其中B、C、E通常情况下是无色气体,A、D为黑色固体,A、E为单质,F为无色液体.它们之间的相互关系如图所示(“→”表示物质间的转化关系,“-”表示物质间可以相互反应).请回答: