题目内容
10.硫酸工业的部分生产流程如图:SO2 $→_{V_{2}O_{5}}^{O_{2}}$SO3→H2SO4某硫酸生产厂以黄铁矿(主要成分为FeS2)为原料生产硫酸,首先将矿石粉吹入沸腾炉里燃烧,制得SO2,其反应可表示为:□FeS2+□O2=□Fe2O3+□SO2.
(1)配平矿石粉在沸腾炉中燃烧的反应方程式4FeS2+11O2=2Fe2O3+8SO2.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
SO2→SO3:2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3; SO3+H2O→H2SO4:SO3+H2O=H2SO4.
(3)SO2→SO3的反应过程中,V2O5的作用是:催化剂.
(4)沸腾炉的炉渣主要成分为Fe2O3,可变废为宝用于炼铁.写出高炉炼铁主要反应的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(5)市售硫酸多为98%的浓硫酸,实验室常将浓硫酸稀释成稀硫酸使用.稀释操作时,必须将浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌,否则会造成危险.
分析 化学反应前后,元素的种类不变,原子的种类、总个数不变;
二氧化硫和氧气在催化剂作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
浓硫酸具有强腐蚀性,溶于水放出大量的热.
解答 解:(1)矿石粉在沸腾炉中燃烧的反应方程式为:4FeS2+11O2=2Fe2O3+8SO2.
故填:4FeS2+11O2=2Fe2O3+8SO2.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
二氧化硫和氧气在催化剂作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸,反应的化学方程式为:2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3,.
故填:2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;H2O;SO3+H2O=H2SO4.
(3)SO2→SO3的反应过程中,V2O5的作用是催化剂.
故填:催化剂.
(4)高炉炼铁主要反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(5)稀释操作时,必须将浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌,否则会造成危险.
故填:浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
18.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑
残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图1所示:
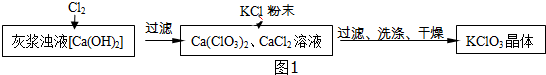
(1)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(2)有关物质在常温下的溶解度如表:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3 晶体的原因是相同温度下,氯酸钾的溶解度小.
(3)洗涤时,可以选用下列BC作洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图2所示(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
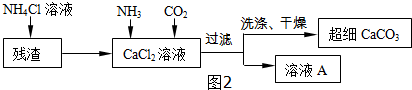
(4)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑
残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图1所示:

(1)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(2)有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(3)洗涤时,可以选用下列BC作洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图2所示(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(4)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.

 分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: