题目内容
8.50g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到98g硫酸盐固体,则反应产生的氢气质量为( )| A. | 0.8g | B. | 1.0g | C. | 1.2g | D. | 1.4g |
分析 镁、锌、铁的混合物50g与足量的稀硫酸完全反应后,生成硫酸镁、硫酸锌、硫酸亚铁的混合物98g,根据反应前后元素质量不变,则硫酸镁、硫酸锌、硫酸亚铁三种物质的混合物中含硫酸根的质量为798g-50g=48g;根据硫酸中氢元素与硫酸根的比,计算出氢元素的质量,即产生氢气的质量.
解答 解:镁、锌、铁都能够和稀硫酸反应生成氢气,根据题意可以知道:镁、锌、铁的混合物50g与足量的稀硫酸完全反应后,生成硫酸镁、硫酸锌、硫酸亚铁的混合物98g,根据反应前后元素质量不变,则硫酸镁、硫酸锌、硫酸亚铁三种物质的混合物中含硫酸根的质量为98g-50g=48g;
硫酸的化学式为H2SO4,其中氢元素与硫酸根的质量比=(1×2):(32+16×4)=1:48,
则硫酸中所含硫酸根的质量为48g时,硫酸中氢元素的质量=1g,即反应中产生的氢气质量为1g.
故选B.
点评 本题难度不是很大,顺利解题技巧在于:由金属元素和硫酸根组成的硫酸盐中,减去金属的质量即为硫酸根的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.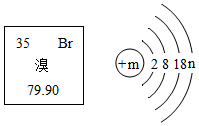 溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
 溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )| A. | 溴相对原子质量为79.90g | |
| B. | 溴原子质量由构成其原子的质子和电子决定 | |
| C. | 溴元素属于金属元素 | |
| D. | m=35、n=7 |
13.括号中的物质是除去杂质所需的药品,其中正确的是( )
| A. | CO2中有少量HCl气体(氢氧化钠溶液) | B. | NH4Cl中有杂质KCl(氢氧化钾) | ||
| C. | FeSO4溶液中有杂质CuSO4(铁粉) | D. | NaCl中有杂质MgCl2(氢氧化钙) |
 如图是家用挂烫机各部件示意图,请据图回答下列问题:
如图是家用挂烫机各部件示意图,请据图回答下列问题: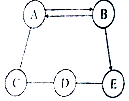 A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去),请回答下列问题:
A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去),请回答下列问题: ”表示催化剂).则水分解微观过程的正确顺序是 ( )
”表示催化剂).则水分解微观过程的正确顺序是 ( )