题目内容
13.为测定一废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为8%,则样品中未被锈蚀的铁元素占原金属铁的质量分数约为( )| A. | 80% | B. | 56% | C. | 20% | D. | 70% |
分析 根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据$\frac{氧化铁中铁的质量}{铁的质量}$×100%即可求得结果
解答 解:设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=$\frac{8%x}{\frac{16×3}{56×2+16×3}}$=$\frac{4}{15}$x;
被腐蚀的铁的质量=$\frac{56×2}{56×2+16×3}$×100%×$\frac{4}{15}$x=$\frac{14}{75}$x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:$\frac{\frac{14x}{75}}{x-8%x}$×100%≈20%,则样品中未被锈蚀的铁元素占原金属铁的质量分数约为:1-20%=80%.
故选:A
点评 本题难度不是很大,主要考查了根据反应的能否发生来判断金属的活动性顺序,从而培养学生对金属活动性顺序的灵活应用,同时通过计算考查学生运用化学式和元素的质量分数公式进行计算的能力:样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.

练习册系列答案
相关题目
3.同学们运用对比的学习方法探究碱的性质.
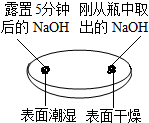
(1)由实验一、二可知,氢氧化钠会吸收空气中的二氧化碳和水,因此要密封保存.
(2)实验三种观察到3个塑料瓶变瘪的程度为A>B>C,对此A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液.
(4)某同学发现工业上使用的氢氧化钠固体标签如图所示,于是对其成分进行了探究:

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】①在华工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.
提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过滤稀盐酸.
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中含有氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
 | 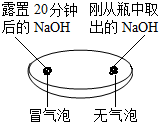 |  |
(2)实验三种观察到3个塑料瓶变瘪的程度为A>B>C,对此A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液.
| 实验一 | 实验二 | 分析 |
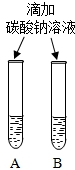 | 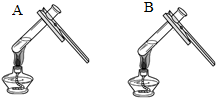 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】①在华工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.
提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过滤稀盐酸.
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中含有氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
4.推理是一种重要的学习方法,下列推断正确的是( )
| A. | 酸雨的pH小于5.6,所以pH小于5.6的雨水一定是酸雨 | |
| B. | 碱溶液能跟某些非金属氧化物反应,所以碱溶液能吸收一氧化碳气体 | |
| C. | 酸性溶液能使紫色石蕊溶液变红,所以能使紫色石蕊溶液变红的溶液呈酸性 | |
| D. | 碳酸盐与稀盐酸反应生成气体,所以与稀盐酸反应生成气体的物质一定是碳酸盐 |
1.如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )


| A. | t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A | |
| B. | 当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A | |
| C. | 将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>A | |
| D. | 升高温度可使接近饱和的C溶液变为饱和 |
1.从事科学实验的重要环节是进行科学实验的设计,科学实验设计的正确步骤应为( )
①充分占有资料②设计合理方案③明确实验目的④进行科学实验.
①充分占有资料②设计合理方案③明确实验目的④进行科学实验.
| A. | ③①④② | B. | ①③②④ | C. | ③①②④ | D. | ①③②④ |
2.已知金属元素M(只有一种化合价)的氧化物的化学式为M2O3,则它的氯化物的化学式为( )
| A. | MCl | B. | MCl2 | C. | MCl3 | D. | MCl4 |
19.在下列变化中,能证明分子可分的事实是( )
| A. | 水蒸发变成水蒸气 | B. | 从空气中分离出氧气 | ||
| C. | 水在直流电作用下变成氢气和氧气 | D. | 海水通过蒸馏得到淡水 |