题目内容
13.试管是初中化学实验室中最常见的仪器,在不同的化学实验中试管口的朝向各不相同,如图所示:请仿照示例,从图中另选一种试管口朝向,并具体说明其在化学实验中的应用.
示例:图①的试管口略向下倾斜,应用在给固体药品加热的实验中.

举例:图③的试管口向上倾斜约与水平面成45°角,应用在给试管中的液体药品加热(合理均可).
分析 根据试管的用途和使用时的注意事项回答.
解答 解:根据试管的用途和使用注意事项可知:图②试管口向下应在放置试管或排空气法收集气体时用;图③的试管口向上倾斜约与水平面成45°角,应用在给试管中的液体药品加热或取用液体药品;图④的试管横放,应用在向试管中加入密度较大的块状固体药品.
故答案为:图③的试管口向上倾斜约与水平面成45°角,应用在给试管中的液体药品加热(合理均可).
点评 仪器的名称和用途,以及使用方法和注意事项,是实验考查的基本内容,也是考查热点之一,历年中考,不论分值多少,总有题目出现,所以要引起重视.

练习册系列答案
相关题目
8.下列实验操作中,正确的是( )
| A. |  读取液体体积 | B. |  倾倒液体 | C. |  滴加液体 | D. |  加热液体 |
18.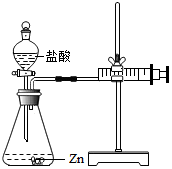 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
5.物质的用途和性质密切相关.下列用途主要是利用其化学性质的是( )
| A. |  铜丝作导线 | B. |  氢气作高能燃料 | ||
| C. |  新材料制成隔水透气鸟笼 | D. |  生铁制成铁锅 |
3.下列实验中无明显现象的是( )
| A. | NaHCO3溶液中滴入稀盐酸 | B. | 将稀盐酸加入NaOH溶液 | ||
| C. | 将NH4NO3加入蒸馏水中并不断搅拌 | D. | 将(NH4)2SO4和熟石灰混合研磨 |
 化学概念间有包含、并列、交叉等不同关系.下列选项符合如图所示关系的是( )
化学概念间有包含、并列、交叉等不同关系.下列选项符合如图所示关系的是( )