题目内容
15.有关物质的量叙述正确的是( )| A. | 1摩尔任何物质都约含有6.02×1023个原子 | |
| B. | 它是七个物理量之一,单位是摩尔 | |
| C. | 1molH2O中约含有3个原子 | |
| D. | 1molH2O的质量是18 |
分析 A.根据1mol任何物质中含有6.02×1023个粒子,进行分析解答;
B.物质的量是七个基本物理量之一,单位为摩尔;
C.根据1mol任何物质中含有6.02×1023个粒子,进行分析解答;
D.M(H2O)=18g/mol,结合n=$\frac{m}{M}$计算;
解答 解:A.1mol任何物质中含有6.02×1023个粒子,但1mol任何物质不一定都约含有6.02×1023个原子,由多原子构成的分子,如1mol氢气中含有6.02×1023个×2=12.04×1023个原子.错误
B.物质的量是七个基本物理量之一,单位是摩尔,故正确;
C.1molH2O中约含有6.02×1023水分子故含有3×个6.02×1023原子;故错误;
D.M(H2O)=18g/mol,故1molH2O的质量是18g.故错误;
答案:B.
点评 本题考查物质的量与摩尔间的关系,为基础性习题,明确物质的量是国际单位制(SI)中的七个基本物理量之一,注意物质的量在使用时,必须指明是何种物质,题目难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
6.如图1是实验室用过氧化氢分解制取氧气并用排水法收集的实验.请按要求回答问题:
(1)检验该气体是否为氧气的方法是将带火星的木条伸入瓶中,若木条能复燃,说明是氧气.
(2)若用如图2的装置来收集干燥的氧气,氧气应从②进入.(填①或②)
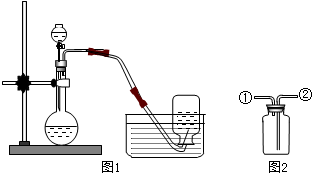
(3)实验之后,该同学展开探究:催化剂二氧化锰的用量对反应速率有怎样的影响?他做了这样一组实验,每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集700毫升氧气所用的时间,结果如下:
从表中数据看出:二氧化锰的用量对反应速率有影响,描述二氧化锰的用量对反应速率有怎样的影响在一定范围内,二氧化锰的用量越大,反应越快,超过一定量时,反应速度不变.
(4)如果在实验中忘了加入二氧化锰,下列对实验结果的描述正确的是C.
A、不影响化学反应速率 B、氧气总量不变,但是反应速率慢
C、氧气总量变少,且反应速率慢 D、无法产生氧气
(5)若实验室要制取1.6克氧气,理论上需要多少克溶质质量分数为10%的过氧化氢溶液?
(1)检验该气体是否为氧气的方法是将带火星的木条伸入瓶中,若木条能复燃,说明是氧气.
(2)若用如图2的装置来收集干燥的氧气,氧气应从②进入.(填①或②)

(3)实验之后,该同学展开探究:催化剂二氧化锰的用量对反应速率有怎样的影响?他做了这样一组实验,每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集700毫升氧气所用的时间,结果如下:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(4)如果在实验中忘了加入二氧化锰,下列对实验结果的描述正确的是C.
A、不影响化学反应速率 B、氧气总量不变,但是反应速率慢
C、氧气总量变少,且反应速率慢 D、无法产生氧气
(5)若实验室要制取1.6克氧气,理论上需要多少克溶质质量分数为10%的过氧化氢溶液?
3.食品添加剂溴酸钾(KBrO3)会致癌,已被禁用,其中溴元素(Br)的化合价为( )
| A. | +1 | B. | +3 | C. | +5 | D. | +2 |
10.下列元素符号书写正确的是( )
| A. | 氯cL | B. | 铜cu | C. | 硅SI | D. | 铁Fe |
20.下列粒子能保持氮气的化学性质的是( )
| A. | 2N | B. | N | C. | N2 | D. | NO |
7.某兴趣小组的同学用图1所示装置制取氧气,然后进一步探究有关氧气的性质.请回答:
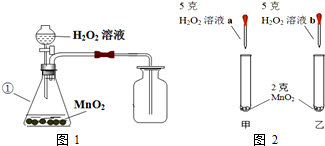
(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
(4)取34克未知浓度的双氧水与2克MnO2混合制取氧气,完全反应至质量不再减轻后,称量剩余混合物的质量为35.2克.
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.

(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
| 溶质质量分数 | 10% | 3% |
| 密度(单位g/mL) | 1.024 | 0.991 |
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.
4.水变成水蒸气,这是因为( )
| A. | 构成水的微粒变成了其他的微粒 | |
| B. | 构成水的微粒不断运动扩散到空气中去 | |
| C. | 构成水的微粒被分解 | |
| D. | 构成水的微粒被阳光吸收 |
5.下列操作中,正确的是( )
| A. |  向试管中滴加液体 | B. |  读取量筒的读数 | ||
| C. |  吹灭酒精灯 | D. |  向试管中加固体粉末 |