题目内容
(1)在氧化铁中铁元素的质量分数为______.
(2)把1000g溶质质量分数为0.1%的某溶液浓缩为0.2%的溶液,需蒸发水的质量为______ g.
(3)将4.9g氯酸钾与1g二氧化锰的混合物加热至完全反应,可制得氧气的质量为______ g.
 .
.(2)设要蒸发水的质量为x,根据溶液蒸发前后,溶质的质量不变,
则1000g×0.1%=(1000g-x)×0.2% x=500g.
(3)解:设可制得氧气的质量为x,
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
4.9g x
 x=1.92g
x=1.92g故答案为:(1)70%;(2)500;(3)1.92.
分析:(1)根据化合物中元素的质量分数=
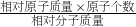 ×100%,进行分析解答.
×100%,进行分析解答.(2)根据溶液蒸发前后,溶质的质量不变,进行分析解答.
(3)根据参加反应的氯酸钾的质量,由反应的化学方程式计算出产生氧气的质量即可.
点评:本题难度不大,掌握化学式的有关计算、溶液蒸发前后溶质的质量不变、化学方程式的计算方法即可正确解答本题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)厨房中的物质 我们的厨房中大多数备有:水、食盐、料酒、食醋、纯碱、铁制的炊具和燃料木炭等.
①请你根据物质的组成,把上述7种物质分类(分类时只考虑各物质的主要成分或有效成分),要求用框图的形式表示,物质用其主要成分或有效成分的化学式表示,层次分明.

②用铝制炊具盛放食醋,一段时间后会发现有气泡产生.试写出可能发生的两个反应的化学方程式(醋酸的化学式用“HAc”代替):
(2)厨房中的锅具 制造锅具的材料很多,如铁锅、铜锅、铝锅、不锈钢锅、不粘锅等.
①请仿照示例各指出一条下列锅具的优点和缺点
| 种类 | 优点 | 缺点 |
| 示例:铜锅 | 导热性能好 | 成本高,铜锈对人体有害 |
| 铁锅 | ||
| 铝锅 |
③不粘锅是在锅的表面涂上一层特氟隆制成的.特氟隆属于
④铁锅、铜锅、铝锅中,人类最早使用的是铜锅,其次是铁锅,最晚使用的是铝锅,这与金属的冶炼难易有关,其原因是
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在.
由此你可以总结出的一条规律是
⑤我国早在春秋战国时期就开始炼铁、应用金属铁.请你用化学方程式表示用一氧化碳还原氧化铁的化学反应原理
(3)厨房中的食物 均衡膳食,有利于人体健康.
①食物的成分主要有蛋白质、糖类、油脂、

小明为了给自己增加营养,制定了如下食谱:主食:馒头,副食:红烧牛肉、花生米、清蒸鱼,饮料:可乐.从营养均衡的角度,你建议他应增加上述食物中的
小华经常食欲不振,生长迟缓,发育不良,小华体内缺少的元素是
A.铁 B.硒 C.钙 D.锌
②蛋白质是人体不可缺少的营养物质之一.食物中的蛋白质进入人体后,在蛋白酶和水的作用下分解成氨基酸.其中一部分氨基酸在体内重新组合成人体所需的各种蛋白质,一部分被氧气氧化成CO2、CO(NH2)2(尿素)和H2O排出体外,同时放出热量.
a.氨基酸中一定含有的元素有
b.合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%.现测得某奶粉中氮元素的质量分数为2%,请通过计算判断该奶粉是否合格(假设其中的氮元素全部是蛋白质所含的).
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S+ O2  2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
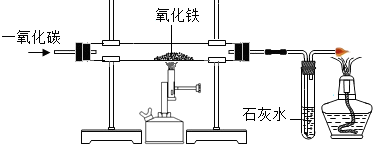
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是Cu2S + O2
 2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu + SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是______(填序号).
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
(1)金属的位置越靠前它的活动性就越强;
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
(3)位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来.
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为______,由此我发现了一条新的判断依据______.
(4)炼铁的原理是利用一氧化碳与氧化铁反应.在实验室里,可用右图所示装置进行实验:实验中玻璃管内的粉末由红色变为______色,该反应的化学方程式为______,通过实验我可以得出的一氧化碳的相关化学性质是______.
(5)工业上火法炼铜的一个主要反应是 Cu2S+O2
 2Cu+SO2 Cu2S中铜元素的质量分数为______(写出算式).
2Cu+SO2 Cu2S中铜元素的质量分数为______(写出算式).用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.