题目内容
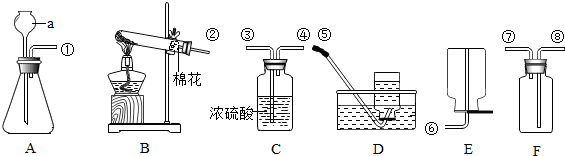
17.如图所示为实验室常见气体制备,净化、干燥、收集和和性质实验的部分仪器(组装实验装置时,可重复选择仪器).某学校两个化学实验探究活动小组的同学欲用他们完成各自的探究实验.(1)第一组的同学以石灰石和稀盐酸为原料,在实验室制备、收集干燥纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性.(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)

①若将二氧化碳通入澄清石灰水中,石灰水的pH将减小(填“增大”“减少”“不变”之一).
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象,欲用化学方法证明CO2和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、无色酚酞溶液三种试剂中选用一种试剂进行实验,简述证明的理由:CaCl2溶液,氯化钙会与碳酸钠反应生成碳酸钙沉淀,氯化钠和氢氧化钠、碳酸钠都不会反应,氢氧化钠、碳酸钠都显碱性,都能使无色酚酞变红色.
(2)第二组的同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某种尼龙材料的组成元素进行分析探究(资料显示该尼龙材料一定含C、H、O三种元素).实验前检验装置气密性,使该塑料式样碎屑在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应,澄清石灰水足量),试回答下列问题:
①所选仪器的连接顺序为ABEBDG(注意:填写仪器序号字母,仪器可以重复使用);
②仪器A中所发生反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③仪器E的玻璃管中放入的塑料试样碎屑质量为mg,塑料试样充分燃烧后,测得仪器D质量增加ag,则mg该塑料试样中含碳元素的质量为$\frac{3a}{11}$g(计算结果可为分数形式).
分析 (1)①根据将二氧化碳通入澄清的石灰水中,二氧化碳和石灰水反应生成碳酸钙和水,溶液的碱性变小(氢氧化钙被消耗)进行分析;
②根据氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,要证明二氧化碳和氢氧化钠反应,只要证明反应生成了碳酸钠即可;
(2)①要证明塑料只含C,H,O三种元素,可让塑料在氧气中燃烧,测出生成的二氧化碳和水的质量,根据质量守恒定律,利用二氧化碳和水的质量可求出塑料中C、H、O三种元素的质量.根据题目要求和各装置的作用排出正确的顺序即可;
②根据A装置内以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,产生水和氧气进行分析;
③根据二氧化碳能使澄清的石灰水变浑浊.D装置增加的质量就是生成的二氧化碳的质量;根据质量守恒定律:塑料中碳元素的质量和生成的二氧化碳中碳元素的质量相等进行分析.
解答 解:(1)①若将二氧化碳通入澄清的石灰水中,二氧化碳和石灰水反应生成碳酸钙和水,溶液的碱性变小,所以溶液的pH变小;
②由于氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,要证明二氧化碳和氢氧化钠反应,只要证明反应生成了碳酸钠即可.可取少量反应后的溶液,滴入CaCl2溶液,产生白色沉淀,证明CO2和NaOH溶液确实发生了化学反应(NaCl溶液和氢氧化钠溶液、碳酸钠溶液都不反应,故不选;由于碳酸钠溶液和氢氧化钠溶液都显碱性,滴加酚酞溶液都显红色;故不选);
(2)①要证明塑料只含C,H,O三种元素,可让塑料在氧气中燃烧,测出生成的二氧化碳和水的质量,根据质量守恒定律,利用二氧化碳和水的质量可求出塑料中C、H、O三种元素的质量.其中A装置和特点是固体和液体反应且不需加热,故可用来制取氧气,此时氧气中含有一定量的水蒸气,故要除去(B装置中有浓硫酸,浓硫酸具有吸水性,可降去氧气中的水分),塑料在E中燃烧,产生的气体先被B吸收(根据B装置质量的增加可求生成水的质量),再通过D装置(装置内石灰水可吸收二氧化碳,可根据质量的增加求出二氧化碳的质量),为防止空气中的水分和二氧化碳进入D装置,故在D后可加G装置,所选仪器的连接顺序为:A→B→E→B→D→G;
②A装置内以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,产生水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③二氧化碳能使澄清的石灰水变浑浊,D装置增加的质量就是生成的二氧化碳的质量,二氧化碳中碳元素的质量=ag×$\frac{12}{12+16×2}$×100%=$\frac{3a}{11}$g;根据质量守恒定律:塑料中碳元素的质量和生成的二氧化碳中碳元素的质量相等,所以塑料中碳元素的质量为:$\frac{3a}{11}$g.
故答案为:(1)①减少;②CaCl2溶液,因为二氧化碳与氢氧化钠反应会生成碳酸钠,故可加入CaCl2溶液,观察到有沉淀产生,就可以证明二氧化碳与氢氧化钠发生了反应;
(2)①ABEBDG;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③$\frac{3a}{11}$.
点评 本题考查了常见气体的制取、干燥、除杂、收集及反应原理的书写等.综合性较强,在利用氧气的性质测定塑料的组成元素时,要注意区分各步操作的作用和目的,利用质量守恒定律进行相关问题的分析.

 优加精卷系列答案
优加精卷系列答案| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | 城市 | 污染指数 | 首要污染物 | 空气质量等级 |
| 北京 太原 杭州 福州 武汉 哈尔滨 | 92 218 67 42 83 96 | TSP TSP TSP NOX TSP | Ⅱ Ⅳ Ⅱ Ⅰ Ⅱ Ⅱ | 天津 广州 重庆 上海 珠海 长春 | 82 126 98 74 47 103 | TSP NOX SO2 NOX TSP | Ⅱ Ⅲ Ⅱ Ⅱ Ⅰ Ⅱ |
| 注:(1)TSP为总悬浮颗粒物;NOX为氮的氧化物,SO2为二氧化硫, (2)空气质量等级,Ⅰ最好,Ⅱ次之,Ⅲ较差,Ⅳ最差 | |||||||
(2)北方城市中,空气质量最差的城市是太原其首要污染物为TSP.
(3)南方城市中,空气质量最差的城市是广州其首要污染物产生的人为原因主要是汽车尾气的排放,对于这个原因,可采取的相应措施为AE(多选题,填序号).
A.植树种草,大力发展城市绿化 B.优化道路设计,保持车辆畅通
C.大力发展污水处理 D.市区禁止汽车鸣号,控制噪声
E.使用无铅汽油,淘汰燃油助动车 F.实行垃圾分类,化废为宝,综合利用.
| A. | 滤渣中一定不含铜 | B. | 滤渣可能是铜和铁的混合物 | ||
| C. | 滤液中含有氯化亚铁和稀盐酸 | D. | 滤液中含有氯化亚铁和氯化铜 |
| A. | Z的化学式为XY3 | |
| B. | 该方程式可表示1个X2分子与3个Y2分子反应生成了2个Z分子 | |
| C. | 若 X2和Y2的相对分子质量分别是M和N,则Z的相对分子质量为(M+N) | |
| D. | 若agX2完全反应生成 b g Z,则同时消耗(b-a)g Y2 |

【问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】(1)木炭与CuO的反应是氧化还原反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O.
【实验过程】小组的同学按图乙装置进行实验,待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
| 步 骤 | 现 象 | 结 论 |
| 取反应后的红色固体装入试管, 滴入足量的稀硫酸,充分反应 | 红色固体部分减少, 溶液变为蓝色 色 | 红色固体的成分既有Cu也有Cu2O |