题目内容
7.草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,并用热重法(TG)确定其分解后所得固体产物的组成,探究过程如下:【查阅资料】
A.草酸亚铁晶体热分解的气体产物是H2O,CO,CO2
B.白色的无水CuSO4遇水蒸气会变成蓝色
C.还原氧化铜的气体需纯净、干燥
【实验设计】(如图1)
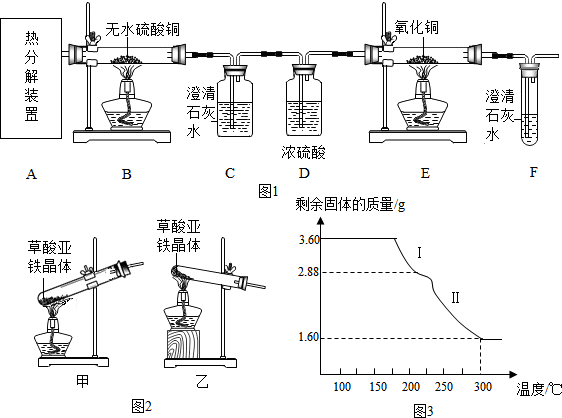
(1)从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气.
(2)可选择图2实验装置中的乙(选填“甲”或“乙”)作为虚线中的“热分解装置”.
【问题讨论】
(3)D中浓硫酸的作用是干燥气体,实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色固体变红色(填实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2.
(4)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是将装置中的空气排尽,防止CO和空气的混合气体受热爆炸.
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有CO,则需在C和D装置之间增加盛有NaOH溶液的洗气瓶,该洗气瓶的作用是NaOH.
【数据分析】
(6)称取3.60g草酸亚铁晶体(FeC2O4•2H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图3所示,请分析该图回答下列问题:
①过程Ⅰ发生反应的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑.
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式或名称Fe2O3.(请写出计算过程)
分析 (1)一氧化碳有毒,扩散到空气中会污染环境;
(2)加热固体物质时,试管口应该略向下倾斜;
(3)浓硫酸具有吸水性,氧化铜能和还原剂发生反应;
(4)可燃性气体或粉尘与氧气混合达到一定程度时,遇明火会发生爆炸;
(5)氢氧化钠溶液能够吸收二氧化碳;
(6)根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气.
故填:没有处理尾气.
(2)“热分解装置”应该选择乙装置.
故填:乙.
(3)D中浓硫酸的作用是干燥气体,实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色固体变红色,则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2.
故填:干燥气体;黑色固体变红色.
(4)进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是:将装置中的空气排尽,防止CO和空气的混合气体受热爆炸.
故填:将装置中的空气排尽,防止CO和空气的混合气体受热爆炸.
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有CO,应该把分解生成的二氧化碳除尽,只要在C和D装置之间增加盛有NaOH溶液的洗气瓶即可.
故填:NaOH.
(6)①通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑.
故填:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑.
②草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3.
故填:Fe2O3.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案①汽车尾气
②化石燃料燃烧产生的烟尘和气体
③动植物呼出的气体
④化工厂排放的废气
⑤植物光合作用产生的气体
⑥沙尘暴.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
| A. | 滤纸上有 Ag、Cu,滤液中只有Zn2+、Mg2+ | |
| B. | 滤纸上有 Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+ | |
| C. | 滤纸上有 Ag、Cu,滤液中有Ag+、Zn2+、Mg2+ | |
| D. | 滤纸上有 Ag、Cu、Zn,滤液中有Zn2+、Mg2+ |
| A. | 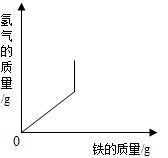 将铁粉加入到一定量的稀盐酸中,生成氢气的质量与加入铁粉的质量关系 将铁粉加入到一定量的稀盐酸中,生成氢气的质量与加入铁粉的质量关系 | |
| B. | 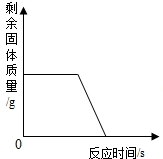 用一定量的一氧化碳和氧化铁反应,剩余固体质量与反应时间的关系 用一定量的一氧化碳和氧化铁反应,剩余固体质量与反应时间的关系 | |
| C. | 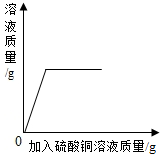 向一定质量铁粉中加入硫酸铜溶液,加入硫酸铜溶液与形成溶液总质量的关系 向一定质量铁粉中加入硫酸铜溶液,加入硫酸铜溶液与形成溶液总质量的关系 | |
| D. | 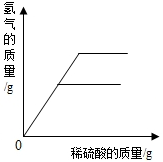 向等质量的金属镁和铝中加入足量且质量分数相等的稀硫酸,生成氢气的质量与加入稀硫酸质量的关系 向等质量的金属镁和铝中加入足量且质量分数相等的稀硫酸,生成氢气的质量与加入稀硫酸质量的关系 |
| A. | 空气中的面粉粉尘 | B. | 空气中的煤粉粉尘 | ||
| C. | 氢气和空气 | D. | 二氧化碳和氧气 |
| A. | FeO(Fe):滴加足量稀盐酸,过滤 | |
| B. | CO(CO2):将气体在空气中点燃 | |
| C. | Cu(NO3)2溶液(AgNO3):加入过量的铜粉 | |
| D. | KCl溶液(CaCl2):加入适量Na2CO3溶液,过滤 |
【查阅资料】氯化钡溶液显中性,且氯化钡和碳酸钠能反应生成碳酸钡白色沉淀和氯化钠.
【提出猜想】假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设一不成立 |
| ②静置,向上层清液中滴加酚酞溶液. | 溶液变红 | 假设二成立 |
(1)步骤①滴加过量的氯化钡溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?不同意,因为加入氢氧化钡溶液引入了OH-,对检验氢氧化钠会造成干扰.
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),因此氢氧化钠应密封保存.
【定量研究】相对原子质量:C-12 O-16 Na-23 Ca-40 Cl-35.5
从该瓶已部分变质为碳酸钠的氢氧化钠溶液中取出100.0g溶液,向其中加入100.0g氯化钙溶液,完全反应后过滤,测得滤液的质量为190.0g.
(计算结果精确到小数点后一位;有关化学方程式:Na2CO3+CaCl2=CaCO3+2NaCl)
(1)反应生成的沉淀质量是10g.
(2)所取的溶液中含碳酸钠的质量是多少克?
( 3)反应后滤液中氯化钠溶质的质量分数?
 化学兴趣小组测定某石灰石样品中碳酸钙的质量分数
化学兴趣小组测定某石灰石样品中碳酸钙的质量分数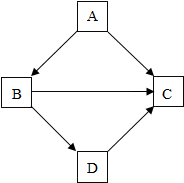 物质间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了如图框图.框图中“”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题:若A、B、C、D分别是Fe、Al、Mg、Cu四种金属的一种,则A的化学式为Mg,D的化学式为Fe.
物质间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了如图框图.框图中“”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题:若A、B、C、D分别是Fe、Al、Mg、Cu四种金属的一种,则A的化学式为Mg,D的化学式为Fe.