题目内容
15.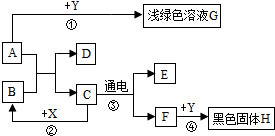 如图所示,A~H是初中化学常见的物质,A和B可发生中和发应,X常用作食品干燥剂,Y为单质.根据图示回答下列问题:
如图所示,A~H是初中化学常见的物质,A和B可发生中和发应,X常用作食品干燥剂,Y为单质.根据图示回答下列问题:(1)B的俗称为熟石灰.
(2)H的化学式为Fe3O4.
(3)反应②的化学方程式为CaO+H2O=Ca(OH)2.
(4)反应③④的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
分析 根据A~H是初中化学常见的物质,A和B可发生中和反应,生成了盐和水,初中以通电为条件的只有电解水,所以C是水,由X常用作食品干燥剂,所以X是氧化钙,能与水反应生成氢氧化钙,所以B是氢氧化钙,A和B可发生中和反应,所以A是酸,能与单质Y反应生成浅绿色溶液G,所以Y是铁,铁能在氧气中燃烧生成黑色的四氧化三铁,所以H是四氧化三铁,则F是氧气,E是氢气,然后将推出的物质进行验证即可.
解答 解:(1)A~H是初中化学常见的物质,A和B可发生中和反应,生成了盐和水,初中以通电为条件的只有电解水,所以C是水,由X常用作食品干燥剂,所以X是氧化钙,能与水反应生成氢氧化钙,所以B是氢氧化钙,A和B可发生中和反应,所以A是酸,能与单质Y反应生成浅绿色溶液G,所以Y是铁,铁能在氧气中燃烧生成黑色的四氧化三铁,所以H是四氧化三铁,则F是氧气,E是氢气,经过验证,推导正确,所以B是氢氧化钙,俗称熟石灰;
(2)通过推导可知,H是Fe3O4;
(3)反应②是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(4)反应③是水在通电的条件下生成氢气和氧气,反应④是铁和氧气在点燃的条件下反应生成四氧化三铁,化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
故答案为:(1)熟石灰;
(2)Fe3O4;
(3)CaO+H2O=Ca(OH)2;
(4)2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

| A. | 尿素、氨水、碳酸氢钠属于氮肥 | B. | 萘、铁、冰属于晶体 | ||
| C. | 干木头、金属、石墨属于导体 | D. | 酱油、黑芝麻糊、蒸馏水属于混合物 |
| A. | KCl(K2CO3)-加足量稀硫酸、过滤、蒸发、结晶 | |
| B. | BaSO4(BaCO3)-加足量稀盐酸、过滤、洗涤、干燥 | |
| C. | CO2(HCl)-先通过氢氧化钠溶液,后通过浓硫酸 | |
| D. | KCl(MnO2)-加水溶解、过滤、洗涤、干燥 |
| A. | 酸中肯定含有氢元素 | |
| B. | 碱一定由金属阳离子与氢氧根离子结合形成 | |
| C. | 分子的质量一定大于原子的质量 | |
| D. | 空气中含量最多的元素是氮 |