题目内容
17.金属在日常生活、工农业生产和科学研究方面应用广泛.(1)铝比铁活泼,但铝的抗腐蚀性比铁要强,原因是铝与空气中的氧气反应,表面形成致密的氧化铝薄膜.
(2)某实验小组为探究影响金属与酸反应快慢的因素,进行以下实验:
| 实验序号 | 实验过程 | 实验现象 |
| a | 锌粉和铁粉分别与5%的盐酸反应 | 锌粉产生气体快 |
| b | 铁粉和铁片分别与15%的盐酸反应 | 铁粉产生气体快 |
| c | 铁片分别与5%的盐酸和15%的盐酸反应 | 15%的盐酸产生气体快 |
A.金属活动性,活动性越强,反应速率越快;b.金属与酸的接触面,接触面越大,反应越快;c.酸的浓度,酸的浓度越大,反应越快.
(3)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到的滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是Zn+2AgNO3═Zn(NO3)2+2Ag.
②若滤液为蓝色,则滤液中一定含有的金属离子是Zn2+、Cu2+(写离子符号).
分析 (1)在空气中,铝能和空气中的氧气反应生成氧化铝;
(2)根据实验现象可以判断相关方面的问题;
(3)锌比铜活泼,铜比银活泼,将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中时,硝酸银先和锌反应生成硝酸锌和银,当锌完全反应后,硝酸银再和铜反应生成硝酸铜和银.
解答 解:(1)根据铝在空气容易形成致密的氧化物,所以铝在空气中具有很好的抗腐蚀性能的原因是:铝与空气中的氧气反应,表面形成致密的氧化铝薄膜;
(2)a、镁粉产生气体的速度快,说明活动性越强,反应速率越快;
b、铁粉与盐酸的接触面积比铁片与酸的接触面积大,而铁粉的产生气体快,说明金属与酸反应的速率与金属和酸的接触面积有关,即接触面积越大反应越快;
c、铁片分别与5%盐酸和10%盐酸反应,10%盐酸产生气体快,说明金属与酸反应的速率是否与酸的浓度有关,即浓度越大反应速率越快.
由此得出影响金属与酸反应快慢的因素有:
(3)①锌和硝酸银溶液反应的化学方程式是:Zn+2AgNO3═Zn(NO3)2+2Ag.
故填:Zn+2AgNO3═Zn(NO3)2+2Ag.
②若滤液为蓝色,说明铜和硝酸银反应生成了硝酸铜,则滤液中一定含有的金属离子是Zn2+、Cu2+.
故填:Zn2+、Cu2+.
答案:
(1)铝与空气中的氧气反应,表面形成致密的氧化铝薄膜;
(2)a、金属活动性,活动性越强,反应速率越快;b、金属与酸的接触面,接触面越大,反应越快;c、酸的浓度,酸的浓度越大,反应越快.
(3)①Zn+2AgNO3═Zn(NO3)2+2Ag;
②Zn2+、Cu2+.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7. 如图是A、B、C三种物质的溶解度曲线,下列分析正确的是( )
如图是A、B、C三种物质的溶解度曲线,下列分析正确的是( )
 如图是A、B、C三种物质的溶解度曲线,下列分析正确的是( )
如图是A、B、C三种物质的溶解度曲线,下列分析正确的是( )| A. | 50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为 1:2 | |
| B. | 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C | |
| C. | 将C的饱和溶液变为不饱和溶液,采用降温结晶方法 | |
| D. | 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液析出溶质质量大小关系是A>B>C |
8.下列四组物质中,前者属于纯净物,后者属于混合物的一组是( )
| A. | 冰水共存物,纯净的空气 | B. | 氧气,四氧化三铁 | ||
| C. | 白酒,自来水 | D. | 雪碧饮料,澄清的石灰水 |
5.在修建铁路的土石方法爆破中要用到黑火药,黑火药爆炸时发生反应的化学方程式是2KNO3+3C+S$\frac{\underline{\;点燃\;}}{\;}$K2S+3X↑+N2↑,根据以上信息,下列说法正确的是( )
| A. | X的化学式是CO | B. | 黑火药属于混合物 | ||
| C. | 反应前后固体质量守恒 | D. | KNO3属于氧化物 |
12.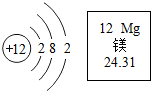 如图是镁原子的结构示意图及镁元素的周期表中的部分信息.下列叙述错误的是( )
如图是镁原子的结构示意图及镁元素的周期表中的部分信息.下列叙述错误的是( )
 如图是镁原子的结构示意图及镁元素的周期表中的部分信息.下列叙述错误的是( )
如图是镁原子的结构示意图及镁元素的周期表中的部分信息.下列叙述错误的是( )| A. | 镁离子符号是Mg2+ | B. | 镁原子在化学反应中易失去电子 | ||
| C. | 镁原子质量是24.31 | D. | 镁属于金属元素 |
2.下列物质属于化合物的是( )
| A. | 稀有气体 | B. | 蒸馏水 | C. | 氢气 | D. | 石灰水 |
9.下列符号中既表示一个原子,又表示一种元素,还表示一种物质的是( )
| A. | C60 | B. | N2 | C. | Cl | D. | Fe |
6.天然气的主要成分是甲烷(CH4),有关描述正确的是( )
| A. | 甲烷的摩尔质量是20g/mol | |
| B. | 甲烷是由碳、氢原子构成的 | |
| C. | l mol甲烷中含有4个氢原子 | |
| D. | l mol甲烷约含6.02×1023个甲烷分子 |
 康康同学做“红磷燃烧前后质量的测定”时,发现反应后托盘天平指针偏向右.请回答:
康康同学做“红磷燃烧前后质量的测定”时,发现反应后托盘天平指针偏向右.请回答: