题目内容
8.下列实验操作错误的是( )| A. |  倾倒液体 | B. |  滴加液体 | C. |  用药勺取用粉末 | D. |  读取液体体积 |
分析 A、取用液体时:注意瓶口、标签的位置,瓶塞的放置等;
B、使用滴管滴加液体时,注意不能伸入试管内部;
C、取用粉末状或小颗粒状的药品时要用药匙或纸槽;
D、量取液体时,视线与液体的凹液面最低处保持水平.
解答 解:A、取用液体时:①试剂瓶瓶口要紧挨试管口;②标签要向着手心,防止液体流出腐蚀标签;③瓶塞要倒放桌面上,防止污染瓶塞,从而污染药品,故A错误;
B、使用滴管滴加液体时,注意滴管要悬空,不能伸入试管内部,更不能接触试管内壁;故B错误;
C、取用粉末状药品时,先将试管横放,把盛药品的药匙或纸槽小心地送入试管底部,再使试管直立,故C正确;
D、量取液体读数时,视线与液体的凹液面最低处保持水平,故D错误.
故选ABD.
点评 本题主要了解各操作的注意事项;考查固体和液体的取用方法、掌握量筒的使用及给滴管的使用方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.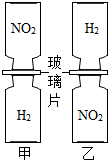 把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )
把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )
 把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )
把分别充满红棕色气体NO2和H2的集气瓶,按图甲、乙两种方式放置,然后把两瓶中间的玻璃片都抽走,使两瓶口密合在一起,可观察到图甲中两瓶气体的颜色很快趋于一致(两气体不反应),而图乙中需较长时间才能达到同样的效果.不能由此现象得出的结论是( )| A. | 分子总是不断运动的 | |
| B. | 甲乙现象的差异与气体的密度有关 | |
| C. | 常温常压下,NO2的密度大于H2的密度 | |
| D. | 分子本身都是有大小的 |
3.下列变化过程中没有发生化学变化的是( )
| A. | 粮食酿酒 | B. | 石灰浆抹墙 | ||
| C. | 菜刀生锈 | D. | 晾干的咸菜表面出现白色晶体 |
19.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,要得到纯净的硫酸亚铁晶体(FeSO4•7H2O),冷却结晶温度应该低于64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出 晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.

 如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:
如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算: 如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作.
如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作. 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.