题目内容
13.我市某校化学兴趣小组的调查报告如下:调查对象:某化工厂排放的废水.
取样地点:废水排放口.
取样时间:2013年5月28日上午9:00.
目测结果:样品略显蓝色,无悬浮颗粒、透明.
实验过程:
①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.
实验结果:废水中含有的大量阴离子是NO3-,肯定含有的阳离子是的Ag+,Cu2+,Ba2+,它们都是重金属离子,对环境有污染.
针对上述情况,某同学设计了一种从废水中除去重金属离子的方案.(已知白色的Fe(OH)2沉淀在氧气和水的存在下会转化为红褐色沉淀.)

假设能发生化学反应的物质均恰好完全反应,则:
(1)X固体为Fe,A固体肯定含有的物质为Cu、Ag
(2)B溶液中的溶质一定有BD
A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
(3)写出④反应的化学方程式:Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3.
分析 运用酸碱盐的化学性质,能较快的正确的解答该题.如废水中含有的大量哪种阴离子,根据①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.这三个现象可知废水中含有银离子、钡离子和铜离子,只有硝酸银能大量溶于水,故溶液中的阴离子是NO3-.
解答 解:废水中含有的大量哪种阴离子,根据①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.这三个现象可知废水中含有银离子、钡离子和铜离子,只有硝酸银能大量溶于水,故答案:NO3-;Ag+,Cu2+,Ba2+.
重金属离子的除杂通常使用置换的方法,Fe粉容易获得而且活泼性比Ag和Cu都活泼,因此X固体是Fe粉,铁粉将Ag+硫和Cu2+置换出来,因此A固体是Ag和Cu,因此溶液中还剩下Ba2+和反应生成的Fe2+,溶液中的阴离子是NO3-,因此B溶液中的溶质一定有Fe(NO3)2和Ba(NO3)2.然后向滤液B中加氢氧化钠,产生白色沉淀又变成红褐色沉淀由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁.C溶液和硫酸钠反应即硝酸钡和硫酸钠反应.
故答案:(1)Fe;Cu、Ag;(2)BD (3)Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3.
点评 只有熟练掌握酸碱盐的化学性质才能快速准确的做出这类题的正确答案.

 某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2),该小组同学进行如下研究.
某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2),该小组同学进行如下研究.探究一:该气体的成分.
【猜想与假设】小王说:该气体可能是CO2、O2、CO、H2、N2.
小李说:不可能含有N2,因为根据化学反应前后元素种类不变,反应物中不含氮元素.
小张说:不可能含有CO和H2,因为从药品安全角度考虑,CO有毒,H2易燃易爆.
该小组同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
| ② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(1)由实验①可知,该气体中肯定含有二氧化碳.写出该反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气.理由是若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃.若要证明含有氧气请你帮助设计方法将气体通入氢氧化钠溶液,再将剩余气体用带火星木条检验.
探究二:维C泡腾片溶液的酸碱性.
(3)向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显酸性.
| A. | 置换反应只能发生在金属与盐溶液之间 | |
| B. | “粗盐中难溶性杂质的去除”只需要溶解和过滤两个步骤就行 | |
| C. | 空气中氧气的体积分数为78% | |
| D. | 发生火灾时,可用湿手巾捂住口鼻低下身子沿墙壁跑出火灾区 |
[提出问题]这白色小石头中含有什么物质?
[查阅资料]小石头被称为“鱼脑石”,用来控制鱼在水中的沉浮.
[猜想与假设]如图:

针对小力的猜想,你构建的假说是“鱼脑石”中含有碳酸钙.
[设计并进行实验]利用给出的试剂:10%稀盐酸,澄清石灰水,紫色石蕊试液.
设计实验针验证小力的猜想.
| 实验方法 | 可能看到的现象 | 结论 | 实验中发生化学反应的方程式 |
| ①取粉碎后的“鱼脑石”,向其中加入稀盐酸 ②将生成的气体通入澄清石灰水 | ①有气泡生成 ②澄清石灰水变浑浊 | 小力的猜想是正确的(鱼脑石中含有CO32-) | CaCO3+2HCl═CaCl2+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |

(1)指出上述装置中标示出的仪器名称:①分液漏斗 ②锥形瓶 ③量筒
(2)实验时,将取一定质量粉碎后的“鱼脑石”放进锥形瓶中,将A和B装置进行连接,从分液漏斗处加入稀盐酸.
思考:B装置中广口瓶上方要放一定植物油的原因是防止二氧化碳溶于水,使收集到的气体偏少.
(3)若装置A中反应剧烈,从实验安全角度考虑,不宜采取的措施有①③(填序号).
①用容积较小的锥形瓶 ②减慢液体的滴加速度
③加热反应物 ④降低液体反应物的浓度
[反思交流]小力同学在B右侧装置中收集到40mL水,他认为反应中产生了40mL气体,但小华同学认为,即使按正确操作进行实验,产生的二氧化碳也不止40mL你认为他做出这样判断的理由是:锥形瓶中还残留一部分二氧化碳你觉得谁的说法正确?小力.
如果实验证明了小力的猜想是正确的,你认为“鱼脑石”中一定含碳酸钙吗?不一定(选填“一定”或“不一定”) 理由是上述实验只证明“鱼脑石”中CO32-的存在,没有证明Ca2+的存在.

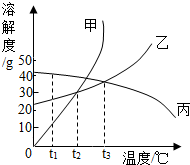 如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题:
如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题: