题目内容
1.某工厂排除的废液中含有SO42-、Cl-、CO32-,用①AgNO3溶液、②Ba(NO3)2溶液、③Zn(NO3)2三种试剂将它们逐一沉淀并加以分离.加入试剂的顺序是( )| A. | ①②③ | B. | ③①② | C. | ③②① | D. | ②③① |
分析 根据已有的离子的检验方法进行分析解答,碳酸根离子能与酸及某些盐反应产生二氧化碳气体会或沉淀,氯离子能与银离子产生氯化银沉淀,硫酸根离子能与钡离子结合产生硫酸钡沉淀,据此解答.
解答 解:检验氯离子使用的是银离子,而银离子能与碳酸根离子、氯离子以及硫酸根离子结合产生沉淀,故不能先加人硝酸银;检验硫酸根离子使用的是钡离子,而钡离子能与碳酸根离子和硫酸根离子结合产生沉淀,故不能先加入硝酸钡;硝酸锌只能和碳酸根离子结合产生碳酸锌沉淀,因此需要先加入硝酸锌检验碳酸根离子,然后加入硝酸钡溶液检验钡离子,最后加入硝酸银检验氯离子,故顺序为:③②①;
故选项为:C.
点评 本题考查了常见离子的鉴别,掌握常见的离子的性质以及离子检验的方法是正确解答本题的关键.

练习册系列答案
相关题目
2. 在学习了“金属的化学性质”后,小吴同学进行了如下探究:
在学习了“金属的化学性质”后,小吴同学进行了如下探究:
【实验目的】比较甲、乙两种金属的活动性强弱和相对原子质量大小.
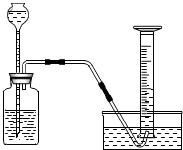
【实验装置】如图
【实验步骤】取两种纯金属各m克,分别加入足量的相同稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积.
【实验数据】
【实验分析】
(1)由实验结果可知:金属活动性较强的是乙.
(2)为了使得到的实验数据准确,小吴开始收集气体的时间点应该是A.
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时
(3)根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道AB.
A.这种条件下,氢气的密度 B.生成物中金属元素的化合价
【实验反思】
(1)实验中,小吴认为两种金属除质量必须相同外,金属还需要满足的条件是形状(或表面积)要相同.
(2)实验中,小吴认为实验结束时收集的氢气体积一定比理论值要大,原因是滴下的稀硫酸也占有一定的体积(其他合理答案也可以).
 在学习了“金属的化学性质”后,小吴同学进行了如下探究:
在学习了“金属的化学性质”后,小吴同学进行了如下探究:【实验目的】比较甲、乙两种金属的活动性强弱和相对原子质量大小.
【实验装置】如图
【实验步骤】取两种纯金属各m克,分别加入足量的相同稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积.
【实验数据】
| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
(1)由实验结果可知:金属活动性较强的是乙.
(2)为了使得到的实验数据准确,小吴开始收集气体的时间点应该是A.
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时
(3)根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道AB.
A.这种条件下,氢气的密度 B.生成物中金属元素的化合价
【实验反思】
(1)实验中,小吴认为两种金属除质量必须相同外,金属还需要满足的条件是形状(或表面积)要相同.
(2)实验中,小吴认为实验结束时收集的氢气体积一定比理论值要大,原因是滴下的稀硫酸也占有一定的体积(其他合理答案也可以).
6.在A+B═盐+水的反应中,A和B不可能是( )
| A. | HCl和NaOH | B. | CO2和NaOH | C. | H2SO4和Ca(OH)2 | D. | H2SO4和BaCl2 |
13.某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应进行,浓硫酸变稀,铁丝与稀硫酸能反应生成氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应进行,浓硫酸变稀,铁丝与稀硫酸能反应生成氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
| 实验方案与步骤 | 实验现象和结论 |
| 1将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色, 则无色气体中有SO2. |
| 将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃. | 若气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |