题目内容
4.某化工企业生产流程图如下:
已知氯化、合成、冶炼三个过程中反应方程式分别为:①2FeTiO3+6C+7Cl2 $\frac{\underline{\;一定条件\;}}{\;}$2X+2TiCl4+6CO
②CO+2H2 $\frac{\underline{\;催化剂\;}}{\;}$CH3OH
③2Mg+TiCl4 $\frac{\underline{\;800℃\;}}{\;}$Ti+2MgCl2
(1)反应中X的化学式为FeCl3,已知钛酸亚铁〔FeTiO3)中铁元素显+2价,则钛元素的化合价为+4价;
(2)钛在高温下能与氧气、氮气等物质化合,在冶炼钛时需充入氩气,原因是防止钛在高温下能与氧气、氮气等物质化合;
(3)钛及钛的合金被誉为“空间金属”,常用于航天航空工业,也可用于造船和化学工业,这是因为钛及钛的合金具有密度小(强度大等)(任写一条〕等优点;
(4)反应中为使原料全部转化为甲醇:投料时理论上应控制CO和H2的质量比为7:1.
分析 (1)根据质量守恒定律分析X的化学式,根据化合价原则求出元素的化合价;
(2)根据钛在高温时的性质分析回答;
(3)根据钛及钛合金的性能分析回答;
(4)反应②中CO和H2的质量比分析回答.
解答 解:(1)反应①观察该反应2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2X+6CO,可知反应前铁原子是2个,钛原子是2个,氧原子是6个,碳原子是6个,氯原子是14个;反应后除2X外,钛原子是2个,氯原子是8个,碳原子是6个,氧原子是6个,根据化学反应前后原子的种类和数目不变,2X中应有6个氯原子和2个铁原子,因此X的化学式为FeCl3;
,已知钛酸亚铁〔FeTiO3中铁元素显+2价,氧为-2价,由化合价原则可推出则钛元素的化合价为+4价;
(2)由题干信息可知,在冶炼钛时需充入氩气,原因是防止钛在高温下能与氧气、氮气等物质化合;
(3)钛及钛的合金被誉为“空间金属”,常用于航天航空工业,也可用于造船和化学工业,这是因为钛及钛的合金具有密度小、强度大、耐腐蚀等优点;
(4)反应②中为使原料全部转化为甲醇:投料时理论上应控制CO和H2的质量比为:28:(2×2)=7:1.
故答案为:(1)FeCl3,+4;(2)防止钛在高温下能与氧气、氮气等物质化合;(3)密度小(强度大等);(4)7:1
点评 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力以及根据质量守恒定律推断物质化学式的能力,难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
1.我市正在实施“水清、天蓝等工程,下列做法错误的是( )
| A. | 禁止直接燃烧烟煤 | B. | 合理使用农药化肥 | ||
| C. | 生活污水直接排到河中 | D. | 对废旧塑料进行回收而不焚烧 |
2.以科学原理和实验事实为依据进行推理是学习化学的重要方法.下列相关结论合理的是( )
| A. | 原子和分子都是微观粒子,原子在化学变化中不能再分,所以分子在化学变化中也不能再分 | |
| B. | 化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物 | |
| C. | 溶液中有晶体析出时,溶液质量减小,所以溶质的质量分数一定减小 | |
| D. | 化学变化过程中常伴有发光发热等现象,所以凡是有发光发热现象发生的变化一定是化学变化 |
19.通过下列实验操作和现象不能得出相应结论的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向燃着蜡烛的烧杯中倒入CO2气体 | 燃着的蜡烛熄灭 | CO2不能燃烧、不能支持燃烧、密谋比空气大 |
| B | 往久置于空气中的氢氧化钠溶液滴加稀盐酸 | 有汽泡 | 氢氧化钠已变质 |
| C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
| D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生 | 该气体是CH4 |
| A. | A | B. | B | C. | C | D. | D |
16.下列不包含化学变化的是( )
| A. | 钢铁生锈 | B. | 澄清石灰水通入二氧化碳后变浑浊 | ||
| C. | 食物腐败 | D. | 食盐溶于水配成溶液 |
14.下列生活中的变化,属于物理变化的是( )
| A. | 铁钉生锈 | B. | 蜡烛燃烧 | C. | 食物变质 | D. | 矿石粉碎 |
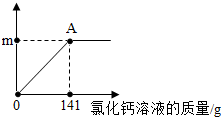 家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算:
家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算: