题目内容
10.请根据如图装置,回答问题.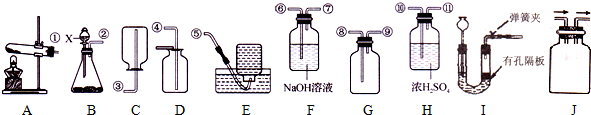
(1)实验室制取H2,可选用装置B(或I),E(填写装置序号)能收集到较纯净的H2.
(2)判断C02已收集满的方法是将燃着的木条放在集气瓶口,若木条火焰熄灭,说明二氧化碳已收集满.
(3)用高锰酸钾制取02,装置A还需做的一点改动是在试管口放一团棉花.
(4)对用氯酸钾和二氧化锰的混合物制取02后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是bcda(填写选项序号).
a.烘干 b.溶解c.过滤 d.洗涤
(5)把(4)中滤液蒸发结晶可得到氯化钾晶体,在蒸发操作中玻璃棒的作用是搅动,防止局部温度过高而造成液滴飞溅(或使受热均匀).
(6)用装置I制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止.其原因是反应产生的气体把液体压到U形管左端,使液体与隔板上的固体分离,停止反应
(7)实验室常用亚硫酸钠(Na2S03)固体与浓硫酸反应生成硫酸钠、水和S02来制取S02.在收集S02,为了避免S02对环境的污染,对S02的收集装置作了改进(如图J),请你把集气瓶内的导管补充完整(图中“→”表示气体流向).
资料已知:S02是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应.
①制取S02的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
②若在实验室中用上述装置制备并收集一瓶干燥的S02气体,且符合“绿色化学”理念所选装置从左至右的连接顺序为B或I、H、F(填字母).
分析 (1)根据反应物的状态与反应条件选用发生装置,根据氢气的性质选用收集装置;
(2)根据二氧化碳的性质即可;
(3)放棉花的目的是防止高锰酸钾粉末随气流进入导管;
(4)反应后物质是氯化钾和二氧化锰,所以根据物理性质的不同可以分离,加水溶解后,二氧化锰留在滤纸上,氯化钾进入滤液,然后蒸发结晶即可;
(5)根据蒸发时玻璃棒的作用来分析;
(6)根据压强的变化即可作出判断;
(7)根据SO2制取时药品的状态和反应所需的条件选择发生装置,根据气体的性质如溶解性,密度,是否与空气中的成分或水发生反应来确定收集装置,尾气要进行处理.
解答 解:(1)在常温下用锌和稀硫酸来制取氢气,因此不需要加热,制取较纯净的H2,可选用排水法收集.
故答案为:B(或I),E;
(2)二氧化碳不会燃烧,也不支持燃烧,故答案为:将燃着的木条放在集气瓶口,若木条火焰熄灭,说明二氧化碳已收集满;
(3)放棉花的目的是防止高锰酸钾粉末随气流进入导管,故答案为:在试管口放一团棉花;
(4)反应后物质是氯化钾和二氧化锰,根据两种物质的溶解性不同,氯化钾溶于水,二氧化锰不溶于水,可以采用溶解、过滤、洗涤、烘干分开,故答案为:bcda;
(5)蒸发中玻璃棒的作用就是边加热边搅拌,防止局部温度过高,造成液体飞溅,故答案为:搅动,防止局部温度过高而造成液滴飞溅(或使受热均匀).
(6)因为SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应,故可用向上排空气法收集,收集装置改进为: ;故填:
;故填: ;
;
当开关关闭后,随着气体的增多,会迫使液体向左端移动,造成液体和固体不接触,故答案为:反应产生的气体把液体压到U形管左端,使液体与隔板上的固体分离,停止反应;
(7)①实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸常温下反应来制取SO2,化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;故填:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②固液常温下制取二氧化硫,选择装置B或I,然后对气体进行干燥,选择H来进行,用G来收集,最后尾气用氢氧化钠溶液来吸收.故填:B或I、H、F.
点评 化学是一门以实验为基础的学科,因此实验仪器的使用,装置的选择,实验原理,注意事项,气体的检验,都是考试热点.

| A. | 分子是构成物质的微粒,因此物质都是由分子构成的 | |
| B. | 氧化物中都含有氧元素,所以含氧元素的化合物都是氧化物 | |
| C. | 使用可燃性气体前,一定要验纯,因此点燃一氧化碳气体前一定要检验其纯度 | |
| D. | 置换反应生成单质和化合物,则有单质和化合物生成的反应一定是置换反应 |
| A. | 试管 | B. | 酒精灯 | C. | 集气瓶 | D. | 烧杯 |
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
(1)用带火星的木条验满氧气的方法是否可靠:否((填“是”或“否”).
(2)收集的氧气占容积的体积分数最低为35%时,可使带火星的木条复燃,这时集气瓶中氧气分数约为48或49%(计算结果保留整数).
(3)用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在大约等于87℃.
| A. | 最外层有8个电子的粒子一定是稀有气体元素的原子 | |
| B. | 核电荷数相同的粒子一定是同种元素的原子 | |
| C. | 含有氧元素的化合物不一定是氧化物 |
| A. | 侯德榜 | B. | 道尔顿 | C. | 门捷列夫 | D. | 拉瓦锡 |
 已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.
已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.