题目内容
5.某学习小组的同学,欲在不使用酸碱指示剂的条件下,通过添加试剂的方法将含有硝酸的硝酸钙溶液变为中性.甲同学提出选用石灰石粉末;乙同学提出选用澄清石灰水.比较甲、乙两同学所选试剂,你认为乙同学的选择不可行,理由是:该试剂虽然能使原溶液变为中性,但在不用指示剂的情况下,采用石灰水中和硝酸很难控制溶液的酸碱性.分析 可以根据物质的性质方面进行分析、判断,从而得出正确的结论.例如,用石灰水中和硝酸时,因为两者反应时无明显现象,无法判断是否恰好完全反应.
解答 解:石灰石不溶于水,和硝酸充分反应后不再溶解.石灰水和硝酸反应没有明显的现象发生,因此无法判断物质是否恰好反应.
故填:乙;在不用指示剂的情况下,采用石灰水中和硝酸很难控制溶液的酸碱性.
点评 解答本题的关键是要掌握物质的物理性质和化学性质,只有这样才能对问题做出正确的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是( )
| A. | 通电使水分解 | B. | 高锰酸钾受热分解 | ||
| C. | 氯酸钾加热分解 | D. | 过氧化氢分解 |
13.金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关.下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究.
【实验记录】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中.
【实验记录】用“√”表示能观察到实验现象,用“-”表示观察不到实验现象(见右表).
实验现象记录表
(1)通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是镁能够在空气中燃烧
(2)运用“控制变量法”设计实验方案是化学研究的重要方法.步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是温度.写出镁和稀硫酸反应的化学方程式Mg+H2SO4═MgSO4+H2↑,此反应属于置换反应(填基本反应类型).
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是Mg>Fe>Cu(用元素符号表示)
【实验记录】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中.
【实验记录】用“√”表示能观察到实验现象,用“-”表示观察不到实验现象(见右表).
实验现象记录表
| 金属 | 空气 | 稀硫酸 | 硝酸银溶液 |
| 铁 | - | √ | √ |
| 铜 | - | - | √ |
| 镁 | √ | √ | √ |
(2)运用“控制变量法”设计实验方案是化学研究的重要方法.步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是温度.写出镁和稀硫酸反应的化学方程式Mg+H2SO4═MgSO4+H2↑,此反应属于置换反应(填基本反应类型).
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是Mg>Fe>Cu(用元素符号表示)
17.某温度下,有一接近饱和的硝酸钾溶液,欲使其变为饱和溶液,采取的措施不当的是( )
| A. | 倒去部分硝酸钾溶液 | B. | 恒温蒸发掉一部分水 | ||
| C. | 降低溶液的温度 | D. | 加入硝酸钾晶体 |
 小红同学欲探究Fe、Cu以及未知金属R这三种金属的活动性顺序,进行了如下实验:
小红同学欲探究Fe、Cu以及未知金属R这三种金属的活动性顺序,进行了如下实验: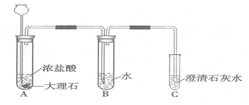 已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:
已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:
 用来测定空气成分的方法很多,如图所示的是用红磷在空气中燃烧的测定方法.实验过程是:
用来测定空气成分的方法很多,如图所示的是用红磷在空气中燃烧的测定方法.实验过程是: