题目内容
10. 关于乙炔(C2H2)的说法正确的是( )
关于乙炔(C2H2)的说法正确的是( )| A. | 该物质属于有机物 | B. | 由碳原子和氢分子构成 | ||
| C. | 相对分子质量为26g | D. | 该物质完全燃烧的产物是碳和水 |
分析 A、根据含有碳元素的化合物叫有机化合物,简称有机物,进行分析判断.
B、根据乙炔(C2H2)是由乙炔分子构成的进行分析判断.
C、根据相对分子的质量的单位不是“g”进行分析解答.
D、根据质量守恒定律进行分析判断.
解答 解:A、乙炔(C2H2)是含有碳元素的化合物,属于有机物,故选项说法正确.
B、乙炔(C2H2)是由乙炔分子构成的,其分子由碳原子、氢原子构成的,不含氢分子,故选项说法错误.
C、相对分子的质量的单位不是“g”,故选项说法错误.
D、乙炔完全燃烧的产物是二氧化碳和水,故选项说法错误.
故选:A.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
20.兴趣小组的同学们在帮助老师整理实验室时,发现一瓶氢氧化钾(化学式KOH)固体,大家决定用实验的方法对这瓶粉末样品展开探究,请你参与.
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
请简述步骤Ⅱ滴加的氯化钙溶液已足量的方法:静置,取上层清液,再滴加CaCl2溶液,若无白色沉淀产生,则CaCl2溶液已足量(写出实验步骤、现象和结论).
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).
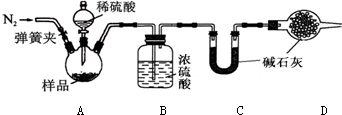
(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取少量样品,加水. | 样品全部溶解 | |
| Ⅱ.取溶液于试管中,滴入足量的CaCl2溶液,过滤. | 产生白色沉淀 | 溶液中含有K2CO3. |
| Ⅲ.取Ⅱ所得的滤液于另一试管中,滴加无色酚酞试液. | 酚酞试液变红色 | 溶液中含有KOH. |
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).

(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.
1.古语道:“人要实,火要虚”.意思是说:“做人要脚踏实地,事业才能有成;燃烧要架空,火才能更旺”.从燃烧的条件看,“火要虚”的实质是( )
| A. | 提高可燃物的着火点 | B. | 增大可燃物的热值 | ||
| C. | 增大可燃物与空气的接触面积 | D. | 提高空气中氧气的含量 |
18.下列图象能正确地表示出对应关系的是( )
| A. |  向一定量稀硫酸中滴加水 | |
| B. |  向一定量的金属锌中滴加稀盐酸 | |
| C. |  向HCl和Na2SO4混合溶液中滴加Ba(OH)2溶液 | |
| D. |  向一定量二氧化锰中逐滴滴加过氧化氢溶液 |


