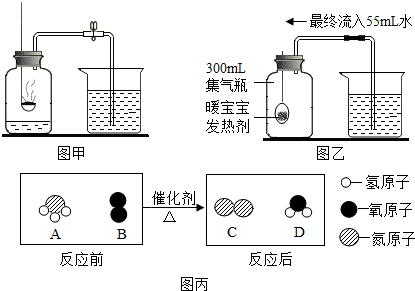
题目内容
8.稀硫酸与氢氧化钠溶液混合没有明显现象,为证明硫酸与氢氧化钠发生了化学反应,小颖同学进行了如下探究: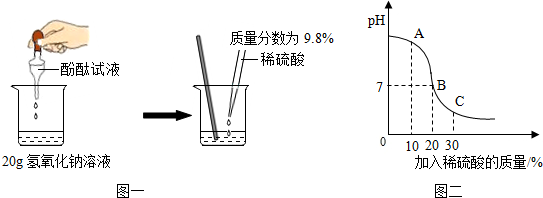
(1)小颖同学通过图一所示的实验,证明硫酸与氢氧化钠发生了化学反应,她依据的实验现象是溶液由红色变为无色.
(2)氢氧化钠是实验室常用药品,下列相关说法中,正确的是BD(填序号).
A.称量:可将NaOH固体直接放在天平左边托盘的纸上进行称量
B.溶解:NaOH固体溶于水时放出大量热,溶解时宜用玻璃棒不断搅拌
C.应急:先用大量水冲洗皮肤上的NaOH溶液,再涂上3%~5%稀盐酸溶液
D.保存:NaOH固体易吸收空气中的水蒸气和CO2,应密封保存
(3)溶液的pH变化与所加入稀硫酸的质量关系如图二所示,图中A点对应溶液中的溶质有NaOH、Na2SO4(写化学式).
(4)根据图示信息,当溶液恰好为中性时,求所得溶液中溶质的质量.(不计滴加的酚酞试液质量,计算精确到0.01g)
分析 (1)根据酸和碱使酚酞试液的变色情况和考虑;
(2)A、根据氢氧化钠具有强烈的腐蚀性进行分析;
B、根据溶解时要用玻璃棒不断搅拌分析;
C、根据碱溶液粘在皮肤上,先用较多水冲洗,再涂上硼酸溶液进行解答;
D、根据已有的氢氧化钠的性质进行分析解答,氢氧化钠具有吸水性和与二氧化碳反应的性质.
(3)根据A点溶液p大于7分析解答;
(4)根据硫酸的质量结合方程式求解硫酸钠的质量.
解答 解:(1)氢氧化钠显碱性,能使酚酞试液变为红色,硫酸与氢氧化钠反应生成硫酸钠和水,硫酸钠显中性,不能使酚酞试液变红,所以溶液由红色变为无色;
(2)A、氢氧化钠具有强烈的腐蚀性,不能放在纸片上称量,应放在烧杯等玻璃器皿中称量,故错误;
B、溶解时要用玻璃棒不断搅拌,加速溶解;正确;
C、当氢氧化钠溶液溅到皮肤上时,应该立即用大量的水冲洗,然后再涂上3%~5%硼酸溶液,而稀盐酸具有腐蚀性,故错误;
D、氢氧化钠具有吸水性,能与空气中的二氧化碳反应而变质,故需要密封保存,故正确;
(3)由图示可知,在a点时溶液的pH大于7,说明NaOH过量,硫酸完全反应,没有剩余,所以溶液中含有的溶质有:Na2SO4、NaOH;
(4)H2SO4质量=20g×9.8%=1.96 g
设 Na2SO4质量为 x,则
H2SO4+2NaOH=Na2SO4+2H2O
98 142
1.96g x
∴$\frac{98}{1.96}$=$\frac{142}{x}$
得 x=2.84g
答:所得溶液中含有硫酸钠 2.84g
故答案为:(1)溶液由红色变为无色 (2)BD (3)NaOH、Na2SO4
(4)2.84g.
点评 本题考查了酸碱中和反应时溶液PH的变化以及反应时物质之间的质量关系,完成此题,可以依据已有的知识以及图示进行.所以要求同学们在平时的学习中加强课本基础知识的储备,以便能够灵活应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A | B | C | |
| A | ↑ | - | |
| B | ↑ | ↓ | |
| C | - | ↓ |
(1)A中溶质的化学式是HCl,A与C反应的基本类型是复分解反应;
(2)A与B、B与C反应的化学方程式分别是Na2CO3+2HCl═2NaCl+H2O+CO2↑、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
| A. | 地球上水资源丰富,人类不缺淡水 | |
| B. | 水在通电条件下可分解为氢气和氧气 | |
| C. | 生活中可以用食盐水区别硬水和软水 | |
| D. | 水由2个氢原子和1个氧原子构成 |
 糕点包装袋中常见的保鲜剂组成为还原性铁粉、氯化钠、炭粉等.某化学兴趣小组为了探究铁粉的作用,设计了如下实验:
糕点包装袋中常见的保鲜剂组成为还原性铁粉、氯化钠、炭粉等.某化学兴趣小组为了探究铁粉的作用,设计了如下实验:【实验装置】
【步骤及现象】
①连接好实验装置,并检查装置气密性.
②按图装好药品M,经过一段时间(各组实验时间相等)后观察现象.
实验现象如下:
| 实验 | M成分 | 实验现象 |
| Ⅰ | 干燥的铁粉、炭粉和氯化钠的混合物 | U型管左、右两端液面相平 |
| Ⅱ | 用氯化钠的溶液浸泡的铁粉、炭粉 | U型管左端液面明显高于右端 |
| Ⅲ | 用水浸泡的铁粉和炭粉 | U型管左、右两端液面基本相平 |
| Ⅳ | 用氯化钠溶液浸泡的铁粉 | U型管左端液面略高于右端 |
(2)实验Ⅱ说明锥形瓶内的气体分子数减少了(填“增多了”、“减少了”或“未改变”),可能的原因是铁粉消耗了锥形瓶中的氧气.其他条件不变,放置一段时间后,实验Ⅱ中U型管两端的液面能否恢复至原来的相平状态?否(填“能”或“否”)
(3)一段时间后,取出锥形瓶中物质,发现实验Ⅱ中铁粉表面有红褐色物质,其他实验中M固体变化不明显,经进一步分析,该红色物质是Fe2O3•nH2O.生成该物质的化学方程式为4Fe+3O2+2nH2O=2Fe2O3•nH2O.
(4)由实验可得出还原性铁粉在食品袋中的作用是除去氧气和水.
【交流与反思】
(5)①有同学根据上述实验探究受到启发:他认为可以用生石灰替代上述保鲜剂,你是否同意他的观点并简述理由:不同意,生石灰只能吸收水蒸气,不能除去食品袋中的氧气,食品会被氧化变质.
②你认为本实验成功的关键是装置气密性良好.

| A. | ①③是不同种元素 | |
| B. | ①④表示的是离子 | |
| C. | ②③的化学性质相似 | |
| D. | ②表示的元素在化合物中通常显+1价 |
| A. | 向某溶液中滴加无色酚酞试液,若试液变红,则该溶液一定是碱溶液 | |
| B. | 向某固体中滴加稀盐酸,若冒气泡,则该固体中一定含有碳酸盐 | |
| C. | 将带火星木条伸入某集气瓶中,若木条没有复燃,则该集气瓶中一定不含有氧气 | |
| D. | 若某物质在氧气中燃烧产生二氧化碳,则该物质中一定含有碳元素 |