题目内容
18.下列说法中正确的是( )| A. | 红磷在氧气中能燃烧,在空气中不能燃烧 | |
| B. | 硫在氧气中燃烧后生成有刺激性气味的气体 | |
| C. | 镁条在氧气中燃烧时,火星四射,生成黑色固体 | |
| D. | 木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光 |
分析 A、根据红磷在空气中不能燃烧进行分析判断.
B、根据硫在氧气中燃烧的现象进行分析判断.
C、根据镁条在氧气中燃烧时的现象进行分析判断.
D、根据木炭燃烧需要点燃进行分析判断.
解答 解:A、红磷在空气中能燃烧,故选项说法错误.
B、硫在氧气中燃烧后生成有刺激性气味的气体,放出热量,故选项说法正确.
C、镁条在氧气中燃烧时,发出耀眼的白光,放出大量的热,生成白色固体,故选项说法错误.
D、木炭燃烧需要点燃,故选项说法错误.
故选:B.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答,在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
相关题目
8.高铁酸钾(K2FeO4)是一种高效多功能净水剂.在高铁酸钾中K为+1价,O为-2价,则Fe的化合价是( )
| A. | +2 | B. | +3 | C. | +6 | D. | -6 |
9.下列关于实验现象的描述不正确的是( )
| A. | 向酚酞试液中通入氨气,溶液变红 | |
| B. | 向淀粉溶液中滴加碘水,溶液变蓝 | |
| C. | 向石蕊试液中通入二氧化碳,溶液变蓝 | |
| D. | 灼烧羊毛,有灼烧羽毛的气味产生 |
6.下列说法正确的是( )
| A. | 木炭可作冰箱除味剂 | B. | 汽油可做除去油污的乳化剂 | ||
| C. | 烧碱可作袋装食品的干燥剂 | D. | 甲醛水溶液可作食品的保鲜剂 |
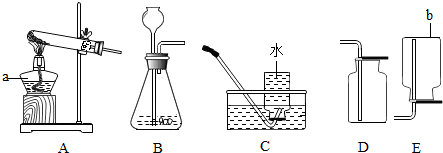
13.空气中氧气含量测定的再认识.
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有BCD.
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.兴趣小组用该方法测出的氧气含量常常远低于21%.
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2)红磷不足装置内氧气有剩余;…
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因白磷的着火点比红磷的着火点低.
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:装置内残留的氧气更少,实验结果更准确.
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
请计算出空气中氧气含量20.2%(计算结果保留一位小数)
【结论与反思】通过上述实验探究,选择铁粉、炭粉、氯化钠和蒸馏水(填物质名称)进行实验,可较为快速地完成实验并减小实验误差.
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由.不能;因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽.

【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有BCD.
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.兴趣小组用该方法测出的氧气含量常常远低于21%.
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2)红磷不足装置内氧气有剩余;…
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因白磷的着火点比红磷的着火点低.
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:装置内残留的氧气更少,实验结果更准确.
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
| 实验前的体积 | 实验后的体积 | |
| 集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
| 131mL | 90.0mL | 63.6mL |
【结论与反思】通过上述实验探究,选择铁粉、炭粉、氯化钠和蒸馏水(填物质名称)进行实验,可较为快速地完成实验并减小实验误差.
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由.不能;因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽.

3.下列示意图与对应的叙述正确的是( )
| A. |  向氢氧化钠溶液中滴加足量的水 | |
| B. |  等质量的不同金属分别放入到足量的相同稀盐酸 | |
| C. |  向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液 | |
| D. |  两份等体积的5%过氧化氢溶液,向其中一份加入少量二氧化锰 |
13.有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质.某兴趣小组为确定其组成设计并进行如下实验.
【实验一】甲组同学进行如下探究.请完成表中空白.
【实验二】乙组同学进行如下探究.
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素.
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2C03+2HCl═2NaCl+H20+C02↑
(2)固体粉末的组成中除Na2C03外,一定还含有的物质是CaC03、NaCl,可能含有的物质是Ca0、Na0H(均填写化学式)
【实验一】甲组同学进行如下探究.请完成表中空白.
| 实验操作 | 实验现象 | 实验结论及分析 | |
| Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有碳酸钙 | |
| Ⅱ.向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中可能含有碱性物质(填“酸性”“碱性”或“中性”) | |
| Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | 有气泡生成 | 原固体粉末中一定含有Na2CO3 | |
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素.
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2C03+2HCl═2NaCl+H20+C02↑
(2)固体粉末的组成中除Na2C03外,一定还含有的物质是CaC03、NaCl,可能含有的物质是Ca0、Na0H(均填写化学式)
14.现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性.
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
【思考结论】
(1)通过上述实验,判断出两种金属的活动性顺序是A<B(填“>”或“<”).
(2)假设其中的一种金属是铁,除观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈浅绿色(填“浅绿色”或“黄色”)
(3)实验前用砂纸打磨金属片的目的是除去金属片表面的氧化物或污物.
(4)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeCl2(合理即可)(填化学式)
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
| 实验 | 试管1 | 试管2 |
| 操作 |  |  |
| 现象 | 金属表面产生气泡较慢 | 金属表面产生气泡较快 |
(1)通过上述实验,判断出两种金属的活动性顺序是A<B(填“>”或“<”).
(2)假设其中的一种金属是铁,除观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈浅绿色(填“浅绿色”或“黄色”)
(3)实验前用砂纸打磨金属片的目的是除去金属片表面的氧化物或污物.
(4)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeCl2(合理即可)(填化学式)