题目内容
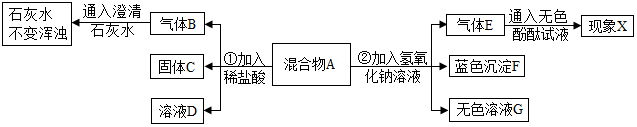
4.某校化学实验小组在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,他们进行了以下探究.【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】(1)铁在加热条件下与浓硫酸发生反应:
Fe+6H2SO4(热、浓)═Fe2(SO4)3+3SO2↑+6H2O
(2)SO2可使品红溶液的红色褪去.
(3)SO2是一种能与碱溶液发生反应的非金属氧化物.
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体中可能有二氧化硫.
【实验探究】小组同学用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.

三组实验后将记录的实验现象和对A中气体成分的分析制成表格,请补充未填入的实验现象.
| A中浓硫酸浓度 | 实验现象 | A中生成 气体成分 | |||
| B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
| 实验Ⅰ | 98% | ① | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验Ⅱ | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | ② |
| 实验Ⅲ | 20% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
【交流反思】实验Ⅰ中D装置的作用是检验二氧化硫是否被氢氧化钠溶液完全吸收.
【拓展延伸】小明又将A装置进行了如图丙所示的改进,该装置的优点是能够形成液封,防止生成的气体逸出并且平衡试管内外的压强,防止停止加热时液体倒吸入试管.
分析 【实验探究】根据实验现象可以判断实验结论,根据实验结论可以判断实验现象;
【实验结论】根据铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸 浓度达到足够大时,生成的气体产物中有二氧化硫解答.
【交流反思】根据氢氧化钠溶液能够吸收二氧化硫,实验Ⅰ中D装置的作用是检验二氧化硫是否被氢氧化钠溶液完全吸收解答;
【拓展延伸】不同的实验装置,功能不同.
解答 解:【实验探究】根据6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑;浓硫酸与铁反应会产生二氧化硫,SO2可使品红溶液的红色褪去;稀硫酸与铁反应产生氢气,有图示数据可知,45%的硫酸与铁反应已产生氢气,故20%的硫酸与铁反应一定产生氢气;
完成实验如下表所示:
| A中硫酸浓度 | 实验现象 | A中生成气体成分 | |||
| B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
| 实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | 有SO2和H2 |
实验三 | 20% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
【交流反思】氢氧化钠溶液能够吸收二氧化硫,实验Ⅰ中D装置的作用是检验二氧化硫是否被氢氧化钠溶液完全吸收;
【拓展延伸】增加的导管下端伸入液面以下原因是形成液封,防止生成的气体逸出;该导管所起的作用是平衡试管内外的压强,防止停止加热时液体倒吸入试管.
故答案为:
【实验探究】
①褪色;②有SO2和H2;
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸 浓度达到足够大时,生成的气体产物中有二氧化硫.
【交流反思】检验二氧化硫是否被氢氧化钠溶液完全吸收;
【拓展延伸】能够形成液封,防止生成的气体逸出并且平衡试管内外的压强,防止停止加热时液体倒吸入试管.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.下列实验操作正确的是( )
| A. |  检查气密性 | B. |  测量溶液的pH | C. |  取固体药品 | D. |  熄灭酒精灯 |
19.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化,再从剩余的浓海水中通过一系列工艺流程提取其他产品.
(1)海水提取镁的一段工艺流程如图:
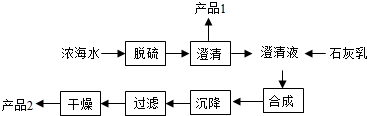
浓海水的主要成分如表:
该工艺流程中需要对海水进行脱硫,原理是用钙离子沉淀硫酸根离子,产品1为CaSO4,过滤后干燥的产品2为氢氧化镁,该反应方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;1L浓海水最多可得到产品2的质量为69.6g.
(2)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁与水在高温下反应生成碱与氢气,该反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(3)如图所示:海水经过晒盐后得到粗盐和苦卤,粗盐中还含有Ca2+、Mg2+、SO42-等可溶性杂质,以下是某化工厂进行粗盐提纯的示意图:
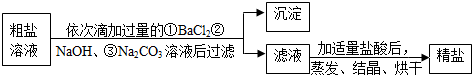
过量试剂①②③的顺序也可调整为②①③,过滤后可得到四种沉淀的化学式为Mg(OH)2、BaSO4、CaCO3、BaCO3;在利用粗盐制备精盐过程中,加入适量盐酸的目的是除去溶液中含有的NaOH,Na2CO3(填物质的化学式).
(4)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
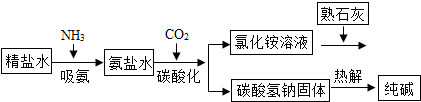
①氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水),氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性;
②写出氯化铵溶液与熟石灰反应的化学方程式2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
(1)海水提取镁的一段工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(2)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁与水在高温下反应生成碱与氢气,该反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(3)如图所示:海水经过晒盐后得到粗盐和苦卤,粗盐中还含有Ca2+、Mg2+、SO42-等可溶性杂质,以下是某化工厂进行粗盐提纯的示意图:

过量试剂①②③的顺序也可调整为②①③,过滤后可得到四种沉淀的化学式为Mg(OH)2、BaSO4、CaCO3、BaCO3;在利用粗盐制备精盐过程中,加入适量盐酸的目的是除去溶液中含有的NaOH,Na2CO3(填物质的化学式).
(4)利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:

①氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水),氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性;
②写出氯化铵溶液与熟石灰反应的化学方程式2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
16.如图是某同学用于测定空气中氧气含量的装置.下列说法错误的是( )
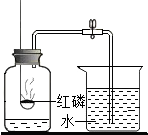

| A. | 实验前一定要检查装置的气密性 | |
| B. | 该实验得出的结论是氧气占空气总体积的$\frac{1}{5}$ | |
| C. | 燃烧的红磷熄灭后,立刻打开止水夹 | |
| D. | 实验时红磷一定要过量,并预先在集气瓶底放少量的水 |
14.下列常见仪器使用正确的是( )
| A. | 试管可以直接加热 | |
| B. | 滴瓶上的滴管使用完后应立即清洗 | |
| C. | 温度计可用来搅拌溶液 | |
| D. | 用燃着的酒精灯去引燃另一个酒精灯 |