题目内容
20.正常的血糖除饭后1小时内血糖浓度略有升高外,其它时间基本维持在0.1% 左右.甲乙两人正常进餐4小时后测定他们的血糖浓度,然后两人同时喝下200毫升质量分数相同的葡萄糖溶液,并每隔半小时测定一次血糖浓度,将测量结果绘成图甲.回答:
(1)两人中血糖浓度正常的是乙
(2)1个小时后甲血糖浓度迅速下降,主要是胰岛素(填人体内的一种激素)的作用.
(3)木糖醇是一种理想的蔗糖替代品,适合糖尿病患者食用.木糖醇和蔗糖的溶解度曲线如图乙,据图回答.
(a)蔗糖在60℃时的溶解度为90克.此温度下木糖醇的溶解度大于蔗糖的溶解度.(选填“大于”、“小于”或“等于”)
(b) 60℃时,向100克水中加入100克木糖醇,充分溶解后,所得溶液的溶质质量:
溶剂质量:溶液质量等于9:10:19.
(c)要将已配成溶质的质量分数为a%的该蔗糖溶液m克,稀释成溶质的质量分数为b%的溶液,需加水的质量为($\frac{am}{b}$-m)克.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)正常的血糖除饭后1小时内血糖浓度略有升高外,其它时间基本维持在0.1%左右,所以两人中血糖浓度正常的是乙;
(2)胰岛素是由胰腺分泌的,主要作用是调节糖的代谢,1个小时后甲血糖浓度迅速下降,主要是因为体内分泌的一种胰岛素的作用;
(3)a、通过分析溶解度曲线可知,蔗糖在60℃时的溶解度为90克,此温度下木糖醇的溶解度大于蔗糖的溶解度;
b、60℃时,木糖醇的溶解度是90g,所以向100克水中加入100克木糖醇,充分溶解后,所得溶液的溶质质量:溶剂质量:溶液质量等于90g:100g:190g=9:10:19;
c、要将已配成溶质的质量分数为a%的该蔗糖溶液m克,稀释成溶质的质量分数为b%的溶液,需加水的质量为:$\frac{mg×a%}{b%}$-mg=($\frac{am}{b}$-m)g.
故答案为:(1)乙;
(2)胰岛素;
(3)a、90,大于;
b、9:10:19;
c、($\frac{am}{b}$-m).
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
10.某课外兴趣小组的同学为了探究金属X、Y、Z三种金属的活动性顺序,进行实验进行了如下探究,请你加入他们一起完成探究:
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式2Z+3H2SO4═Z2(SO4)3+3H2↑(金属就用Z表示);
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
(2)通过实验二并结合实验一的现象分析,可得出X、Y、Z金属活动性由强到弱的顺序为:Z>X>Y.
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
(3)实验⑦和⑧表明:该反应快慢与温度有关;
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
| 实验序号 | ① | ② | ③ |
| 实验步骤 | 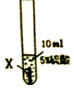 | 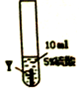 | 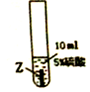 |
| 实验现象 | 在X片表面无明显变化 | Y片表面无明显变化 | Z片溶解,表面有无色氢气产生,溶液最终无色 |
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
| 实验序号 | ④ | ⑤ |
| 实验步骤 | 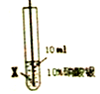 |  |
| 实验现象 | 在X丝表面有银白色的固体析出 | 在Y丝表面没有明显现象 |
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
11.用“●”、“○”、“●”分别表示质子、中子和电子,如图表示四种原子结构模型,有关说法正确的是( )


| A. | 甲、丁互为同位素 | B. | 乙、丁为同一种元素 | ||
| C. | 甲、丙的核电荷数不同 | D. | 甲、丙为同一种原子 |
8. 化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
 化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | NaHCO3+HCl=NaCl+H2O+CO2↑ | D. | Fe+CuSO4=FeSO4+Cu |
5.下列物质不属于酸的是( )
| A. | HNO3 | B. | NaHSO4 | C. | H2SO4 | D. | HCl |
12.写出下列物质的化学式,并指出它们各属于哪一类化合物(选填酸、碱、盐):
| 物质 | 烧碱 | 熟石灰 | 氯化银 | 纯碱 |
| 化学式 | ||||
| 类别 |
9.分析处理图表中的信息是学习化学的一种重要方法.如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
(1)40℃时,氯化钠的溶解度为36.6g;
(2)碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”),在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%);
(3)10℃时,分别配制表中三种物质的饱和溶液,其中溶质质量分数最小的物质是碳酸钠饱和溶液;
(4)将一瓶接近饱和的硝酸钾溶液变成饱和溶液,可采用的方法是②④(填序号);
①升高温度 ②加溶质硝酸钾 ③加水 ④恒温蒸发水
(5)硝酸钾溶液中含有少量氯化钠时,可通过冷却热饱和溶液的方法提纯,对上述提纯后析出的晶体和剩余溶液描述正确的是A(填序号).
A.剩余溶液一定是硝酸钾饱和溶液 B.剩余溶液一定是氯化钠不饱和溶液
C.上述方法可以将两者完全分离 D.析出的晶体中只含有硝酸钾.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37 | 37.3 | 37.8 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | ||||
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
(2)碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”),在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%);
(3)10℃时,分别配制表中三种物质的饱和溶液,其中溶质质量分数最小的物质是碳酸钠饱和溶液;
(4)将一瓶接近饱和的硝酸钾溶液变成饱和溶液,可采用的方法是②④(填序号);
①升高温度 ②加溶质硝酸钾 ③加水 ④恒温蒸发水
(5)硝酸钾溶液中含有少量氯化钠时,可通过冷却热饱和溶液的方法提纯,对上述提纯后析出的晶体和剩余溶液描述正确的是A(填序号).
A.剩余溶液一定是硝酸钾饱和溶液 B.剩余溶液一定是氯化钠不饱和溶液
C.上述方法可以将两者完全分离 D.析出的晶体中只含有硝酸钾.
10.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质.下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
| A. | 能使紫色石蕊溶液变蓝色 | |
| B. | 能与盐酸反应生成水 | |
| C. | 能与CO2反应生成水 | |
| D. | 能与Na2SO4溶液反应生成BaSO4沉淀 |