题目内容
除贡外金属常温下为固体,清华大学刘静教授制造的镓铟这两种金属的合金即使在室温下也能保持液态,而且具有很多神奇特性。下图为镓、铟元素在周期表中的信息。下列有关说法错误的是:
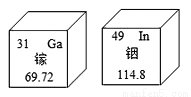
A. 镓原子的核电核数比铟原子少18
B. 铟原子相对原子质量为114.8
C. 镓原子的中子数为31
D. 合金的溶点比组成合金的金属低
练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
10.化学知识在生活中有广泛的应用.下列说法错误的是( )
| A. | 图书档案起火,可用液态二氧化碳灭火器灭火 | |
| B. | 电视机短路起火,可立即用水浇灭 | |
| C. | 室内着火需要自救时,可用湿毛巾捂住口鼻,蹲下靠近地面或沿墙壁跑离着火区 | |
| D. | 厨房天然气泄漏,立即关闭阀门并轻轻开窗通风 |
14.小丽对家中的家用制氧机产生了浓厚的兴趣.她通过阅读说明书了解到家用制氧机的工作原理 如下:
如下:
加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气.减压时,分子筛将所吸附的氮气排放.整个过程中,分子筛并不消耗.
小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究.
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气.
【实验记录】
表中,化学方程式I是C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
 【实验结论】收集的气体是纯净的氧气.
【实验结论】收集的气体是纯净的氧气.
【实验反思】老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气.该实验不能证明所收集气体为纯净氧气的原因是木炭在集气瓶中燃烧得更旺只能说明集气瓶中氧气的含量高于空气中氧气的含量,不能说明集气瓶中氧气含量为100%.
实验II:测定小丽所带气体中氧气的含量.
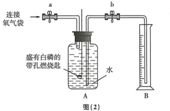
同学们在老师的指导下设计了如图(2)所示装置,进行实验,并重复多次.
【实验记录】
表中,操作I是打开止水夹b;现象I是B中部分水被吸入A中.
【数据记录】
【数据处理】
已知,在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去.小丽所带气体中氧气的体积分数为80%.
【实验反思】
(1)这台家用制氧机制氧气的过程发生的变化属于物理变化(填“物理变化”或“化学变化”).
(2)导致第1组数据产生较大误差的可能原因是白磷不足.
【拓展探究】
探究小组在查阅资料时发现:收集氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小组同学对此展开研究.请根据实验回答下列问题
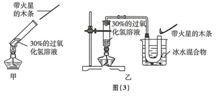 (1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.
(1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.
(2)第一组实验:取5支集气瓶,编号为①、②、③、④、⑤,分别装入其总体积10%、20%、30%、40%、50%上的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表.
收集的氧气占容积的体积分数最低为35%时,可使带火星的木条复燃,这时集气瓶中氧气的体积分数是49%(计算结果保留整数).
(3)小明上网查阅资料时发现:硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气.于是 他决定设计实验来检验硝酸铜分解产生的氧气.
【查阅资料】
①相同条件下,任何气体的体积比等于分子个数之比
②硝酸铜分解后的气体可以完全被氢氧化钠溶液吸收
【设计实验】
小明同学设计如图(4)所示的装置,将硝酸铜固体放入试管中加热,该反应的方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑,然后打开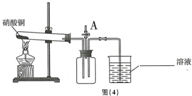 A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.
A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.
【实验反思】
(1)从硝酸铜分解得到的气体能使带火星的木条复燃这一事实,能说明一定生成了氧气吗?不能(填“能”或“不能”).理由是空气中氧气的浓度是21%,带火星的木条并没有复燃,本实验中氧气的浓度只占混合气的20%.那从这一现象可以得到什么结论?二氧化氮支持燃烧.请设计一个简单实验方案证明你的结论:只需要将带火星的木条伸入二氧化氮气体中,如果复燃,即可证明.
(2)为了防止二氧化氮逸出而环境污染,所以烧杯中应该放入氢氧化钠溶液.
 如下:
如下:加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气.减压时,分子筛将所吸附的氮气排放.整个过程中,分子筛并不消耗.
小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究.
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气.
【实验记录】
| 实验步骤 | 实验现象 | 化学方程式 |
| 取一只250mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 | 木炭燃烧得更旺, 然后慢慢熄灭 | 化学方程式I |
 【实验结论】收集的气体是纯净的氧气.
【实验结论】收集的气体是纯净的氧气.【实验反思】老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气.该实验不能证明所收集气体为纯净氧气的原因是木炭在集气瓶中燃烧得更旺只能说明集气瓶中氧气的含量高于空气中氧气的含量,不能说明集气瓶中氧气含量为100%.
实验II:测定小丽所带气体中氧气的含量.
同学们在老师的指导下设计了如图(2)所示装置,进行实验,并重复多次.
【实验记录】
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性 | 装置的气密性良好 | |
| ② | 加入药品,将装置连接固定 | ||
| ③ | 打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b | A中水进入到B中,B中水的体积为200mL. | 收集200mL气体(由压强差引起的误差忽略不计) |
| ④ | 用凸透镜聚光引燃白磷 | 燃烧,产生大量白烟 | |
| ⑤ | 待白磷熄灭并冷却到室温,进行操作I | 现象I | 小丽收集的气体不是纯净的氧气 |
【数据记录】
| 实验次序 | 1 | 2 | 3 | 4 | 5 |
| B中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
已知,在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去.小丽所带气体中氧气的体积分数为80%.
【实验反思】
(1)这台家用制氧机制氧气的过程发生的变化属于物理变化(填“物理变化”或“化学变化”).
(2)导致第1组数据产生较大误差的可能原因是白磷不足.
【拓展探究】
探究小组在查阅资料时发现:收集氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小组同学对此展开研究.请根据实验回答下列问题
 (1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.
(1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.(2)第一组实验:取5支集气瓶,编号为①、②、③、④、⑤,分别装入其总体积10%、20%、30%、40%、50%上的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表.
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
(3)小明上网查阅资料时发现:硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气.于是 他决定设计实验来检验硝酸铜分解产生的氧气.
【查阅资料】
①相同条件下,任何气体的体积比等于分子个数之比
②硝酸铜分解后的气体可以完全被氢氧化钠溶液吸收
【设计实验】
小明同学设计如图(4)所示的装置,将硝酸铜固体放入试管中加热,该反应的方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑,然后打开
 A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.
A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.【实验反思】
(1)从硝酸铜分解得到的气体能使带火星的木条复燃这一事实,能说明一定生成了氧气吗?不能(填“能”或“不能”).理由是空气中氧气的浓度是21%,带火星的木条并没有复燃,本实验中氧气的浓度只占混合气的20%.那从这一现象可以得到什么结论?二氧化氮支持燃烧.请设计一个简单实验方案证明你的结论:只需要将带火星的木条伸入二氧化氮气体中,如果复燃,即可证明.
(2)为了防止二氧化氮逸出而环境污染,所以烧杯中应该放入氢氧化钠溶液.




 B.
B. 
 D.
D. 


