题目内容
19.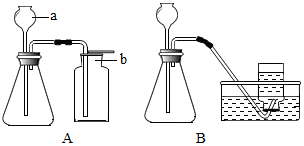 如图是实 验室制取气体的常用装置.请回答:
如图是实 验室制取气体的常用装置.请回答:(1)仪器a名称是长颈漏斗,A装置中的集气装置b只能收集密度比空气大的气体.
(2)实验室用分解过氧化氢(H2O2)的方法来制备氧气,其化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应中,MnO2起催化作用,加快了H2O2的分解.
分析 (1)a为实验室常用的仪器;气体的收集方法主要由气体的密度和溶水性决定.
(2)熟记常用的化学方程式;催化剂在化学反应中起催化作用.
解答 解:(1)熟记常用仪器的名称可知a为长颈漏斗;能用向上排空气法收集的气体应满足的条件是密度比空气大.
故答案为:长颈漏斗;大;
(2)过氧化氢以二氧化锰为催化剂生成水和氧气,其化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;二氧化锰是过氧化氢制氧气的催化剂,催化剂在化学反应起催化作用.
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;催化.
点评 本道题主要考查了气体发生装置和收集装置的选取,收集装置主要由气体的密度和溶水性决定,另外还要考虑气体是否与水反应、是否与空气反应、是否有毒等等.

练习册系列答案
相关题目
14.把6克碳在24克氧气中充分燃烧,生成二氧化碳的质量是( )
| A. | 30克 | B. | 22克 | C. | 32克 | D. | 44克 |
8.通过观察实验现象获得证据,从而归纳出相关结论是科学上常用的研究方法,下列实验现象和对应的结论正确的是( )
| A. | 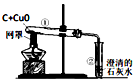 试管①红色粉末变成黑色,试管②的澄清石灰水变浑浊,说明碳具有还原性 | |
| B. |  铁丝表面覆盖红色物质,溶液由蓝色逐渐变成无色,说明铁的金属活动性强于铜 | |
| C. |  烧杯中的红色溶液逐渐变浅最后变成无色,说明盐酸与氢氧化钠能发生反应 | |
| D. | 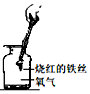 铁丝在氧气中剧烈燃烧、火星四射,生成的黑色物质是氧化铁 |


 利用如图装置进行实验.
利用如图装置进行实验.