题目内容
16.合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等.化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程.称量20g粉末状黄铜样品放入烧杯中,量取60mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的体积(ml) | 20 | 20 | 20 |
| 生成氢气的质量(g) | 0.04 | m | 0.02 |
(1)m的数值0.04.
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
(3)所加稀硫酸溶液的溶质质量分数?(该温度下稀硫酸密度为1.066g/ml,计算结果保留至0.01%)
分析 根据第一次加入20g稀硫酸生成氢气0.04g,而第三次生成0.02g,所以可知第二次也生成0.04g,确定生成的氢气的质量为0.04g+0.04g+0.02g=0.1g.进而根据化学方程式求算参加反应的锌的质量.求算硫酸中溶质应该根据每20mL稀硫酸生成0.04g氢气进行.
解答 解:根据第一次加入20g稀硫酸生成氢气0.04g,而第三次生成0.02g,所以可知第二次也生成0.04g即m=0.04,确定生成的氢气的质量为0.04g+0.04g+0.02g=0.1g.
设锌的质量为x
设参加反应的锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.1g
$\frac{65}{2}$=$\frac{x}{0.1g}$
x=3.25g
此黄铜样品中铜的质量分数为$\frac{20g-3.25g}{20g}$×100%=83.75%
每20mL稀硫酸生成0.04g氢气,20mL稀硫酸的质量为20mL×1.066g/mL=21.32g
设所消耗的硫酸中的溶质的质量为y.
Zn+H2SO4=ZnSO4+H2↑
98 2
y 0.04g
$\frac{98}{2}$=$\frac{y}{0.04g}$
y=1.96g
所加稀硫酸溶液的溶质质量分数为$\frac{1.96g}{21.32g}$×100%≈9.19%
答:(1)m的数值0.04.
(2)此黄铜样品中铜的质量分数是83.75%;
(3)所加稀硫酸溶液的溶质质量分数为9.19%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 氧气罐中的氧气可以供给人呼吸 | B. | 水中氧气的含量为0 | ||
| C. | 氧气被压缩后分子的体积变小了 | D. | 氧气只能以气体的形式存在 |
| A. |  pH试纸的使用 | B. |  检验氧气 | C. |  硫在氧气中燃烧 | D. |  浓硫酸干燥氢气 |
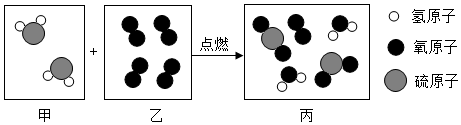
| A. | 分子在化学变化中可以再分 | B. | 乙为氧化物 | ||
| C. | 反应后生成了两种新的化合物 | D. | 丙为混合物 |
| A. | 用小苏打作焙制糕点发酵粉 | B. | 用霉变花生压榨食用油 | ||
| C. | 在猪饲料中添加瘦肉精 | D. | 用硫酸铜溶液制作返青粽叶 |
| 物 质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 12 | 1 | m | 14 |
(2)该反应的基本反应类型为化合反应.
| A. | 3.65% | B. | 7.3% | C. | 14.6% | D. | 21.9% |
| A. | 海洋中繁衍着无数的水生生物.含有100多种化学元素 | |
| B. | 大气资源中含量最少的物质是稀有气体 | |
| C. | 人类可以利用的淡水量不到总水量的1% | |
| D. | 地壳中含量最多的金属元素是铁 |
| A. | 用灼烧法除去氧化铜中的木炭粉:C+O2═CO2 | |
| B. | 用铁和稀盐酸反应来制取氯化铁:2Fe+6HCl═2FeCl3+3H2↑ | |
| C. | 用氢氧化钠和硝酸钾反应来制取氢氧化钾:Ca(OH)2+KNO3═2KOH+Ca(NO3)2 | |
| D. | 用含氢氧化镁的药物治疗胃酸过多症:Mg(OH)2+2HCl═MgCl2+2H2O |