题目内容
10.由两种金属组成的混合物共30g,与足量盐酸完全反应,共放出1gH2,试判断原混合物的组成不可能是( )| A. | Zn 和 Mg | B. | Fe 和Al | C. | Zn 和Fe | D. | Fe和Cu |
分析 假设与酸反应的金属的相对原子质量为x,利用金属与盐酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出x的值,然后根据组合的原则,即可正确解答.
解答 解:设锌、镁、铁、铝在与酸反应时都看作+2价金属,则各金属的相对原子质量分别为:锌:65;镁:24;铁:56;铝:18.铜不与酸反应产生氢气.
产生氢气1克,设与酸反应的金属的相对原子质量为x,根据反应:
M+2HCl═MCl2+H2↑;
x 2
30g 1g
则$\frac{x}{2}=\frac{30g}{1g}$,解之得:x=60;
所以,组成该合金的金属的相对原子质量应该满足一个大于60,一个小于60,故组合可能为:锌与铁、Zn 和 Mg、Fe和Cu.不可能的为B.
故选:B.
点评 本题主要考查学生运用化学方程式和组合的原则解答问题的能力.解题的关键是利用化学方程式计算出组成该合金的金属的相对原子质量应该满足的数值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.实验室常用加热氯酸钾(KClO3)与二氧化锰(MnO2)混合物的方法制取氧气.小芳发现氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰(MnO2)、氧化铜(CuO)外,氧化铁(Fe2O3)也可以作氯酸钾(KClO3)分解的催化剂.
【完成实验】按下表进行实验:测定分解产生氧气的温度(分解温度越低,催化效果越好).
【分析数据、得出结论】
(1)分解所需温度越高,说明反应加热时间越长(填“长”或“短”),反应速度越慢(填“快”或“慢”)
(2)由实验① 与实验④对比,证明猜想合理;
(3)实验所用的MnO2、CuO、Fe2O3,催化效果最好的是MnO2.
【反思】(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度.
【提出猜想】除二氧化锰(MnO2)、氧化铜(CuO)外,氧化铁(Fe2O3)也可以作氯酸钾(KClO3)分解的催化剂.
【完成实验】按下表进行实验:测定分解产生氧气的温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比l:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
(1)分解所需温度越高,说明反应加热时间越长(填“长”或“短”),反应速度越慢(填“快”或“慢”)
(2)由实验① 与实验④对比,证明猜想合理;
(3)实验所用的MnO2、CuO、Fe2O3,催化效果最好的是MnO2.
【反思】(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度.
15. 根据粒子结构示意图给出的信息,下列说法正确的是( )
根据粒子结构示意图给出的信息,下列说法正确的是( )
 根据粒子结构示意图给出的信息,下列说法正确的是( )
根据粒子结构示意图给出的信息,下列说法正确的是( )| A. | ①②③表示的是三个原子 | B. | ③表示的元素是稀有气体元素 | ||
| C. | ①③表示的是阳离子 | D. | ①②表示的元素化学性质相似 |
19.推理是化学学习常用的方法,下列推理正确的是( )
| A. | 将带火星的木条伸入集气瓶中,木条不复燃,则集气瓶中一定不含有O2 | |
| B. | 氦原子和镁原子的最外层电子数相同,则氦原子和镁原子的化学性质相似 | |
| C. | 水电解产生H2和O2,所以水是由氢元素和氧元素组成的 | |
| D. | 二氧化碳通入紫色石蕊溶液后溶液变红,说明二氧化碳具有酸性 |
20.某同学在实验室进行了碳还原氧化铜的实验,实验步骤如表:
实验反思:剩余固体M中一定含有CuO、碳和铜.混合物中仍含有氧化铜的原因可能是碳和氧化铜没有完全反应就停止了加热,或者还可能的原因是从试管B中撤出导管时,有空气进入试管,与灼热的铜再次反应生成氧化铜.
| 实验装置 | 实验步骤 | 分析 |
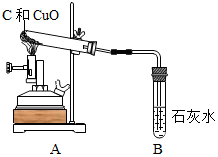 | ①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是B试管处不应该有橡皮塞; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是检验产物是否有二氧化碳; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是防止液体倒流引起试管炸裂; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |

 如图是某化工公司生产的氮肥(尿素)包装标签的部分文字,试计算:
如图是某化工公司生产的氮肥(尿素)包装标签的部分文字,试计算: