题目内容
在实验室里用一氧化碳还原氧化铜制取铜并生成二氧化碳.若制取3.2g铜,需要氧化铜的质量是多少?同时生成二氧化碳的体积是多少?(二氧化碳的密度为1.96g/L)
解:设若制取3.2g铜,需要氧化铜的质量是x,同时生成二氧化碳的质量为y
CuO+CO Cu+CO2↑
Cu+CO2↑
80 64 44
x 3.2g y
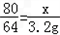 ,
,
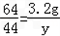
解之得:
x=4g,
y=2.2g,
2.2g÷1.96g/L=1.12L.
答:若制取3.2g铜,需要氧化铜的质量是4g;同时生成二氧化碳的体积是1.12L.
CuO+CO
 Cu+CO2↑
Cu+CO2↑80 64 44
x 3.2g y
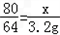 ,
,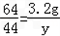
解之得:
x=4g,
y=2.2g,
2.2g÷1.96g/L=1.12L.
答:若制取3.2g铜,需要氧化铜的质量是4g;同时生成二氧化碳的体积是1.12L.

练习册系列答案
相关题目