题目内容
6.金属材料与人类的生产和生活密切相关,请回答:(1)下列用品中,主要利用金属导电性的是C(填字母);
A.铂金饰品 B.铁锅 C.铝导线
(2)金属铝表面常有一层致密的氧化膜,氧化膜主要成分是氧化铝;
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸(主要成分是盐酸)的作用下转化为人体可吸收的铁元素,反应的化学方程式为2HCl+Fe=H2↑+FeCl2;
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液.向滤渣中滴加稀盐酸,有气泡产生,①则滤渣中一定含有的物质是铁、铜;②滤液中一定含有的溶质是硫酸亚铁.
分析 (1)根据金属的性质来推断金属的用途;
(2)金属铝易于空气中氧气反应生成一层致密的氧化铝;
(3)胃酸的主要成分是盐酸,能与铁反应;
(4)根据金属活动性顺序表进行分析:在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:(1)铂金饰品是利用了其价格昂贵、稀有;铝制成导线是利用铝的导电性,铁制成铁锅,是利用金属的导热性;故填:C;
(2)金属铝易于空气中氧气反应生成一层致密的氧化铝保护膜;故填:氧化铝;
(3)胃酸的主要成分盐酸与铁反应生成氢气,化学反应式是:2HCl+Fe=H2↑+FeCl2;故填:2HCl+Fe=H2↑+FeCl2;
(4)根据“在金属活动性顺序里,排在氢前面的金属能与酸反应产生氢气”这一理论,结合题意中的“向滤渣中加盐酸有气泡产生”可以断定反应后的滤渣中的成分是铁或者锌、铁的混合物,一定有铁生成,锌与硫酸亚铁、硫酸铜的混合溶液反应,先置换出铜,因此有铁一定有铜,所以滤渣中一定含有的固体是铁、铜;因为滤渣中存在铁,因此滤液中一定不含的物质是硫酸、硫酸铜,因为不能和铁共存,一定含硫酸亚铁.故答案为:铁、铜;硫酸亚铁.
点评 本题以实验探究的形式考查金属的性质与用途、铝的自我保护、金属的活动性等,难度较大.

练习册系列答案
相关题目
1.下列生活中的变化属于化学变化的是( )
| A. | 用食醋除去水壶中的水垢 | |
| B. | 玻璃窗破裂 | |
| C. | 自来水通过蒸馏变成可饮用的瓶装水 | |
| D. | 用活性炭除去冰箱中的异味 |
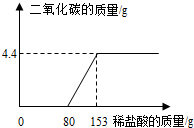 某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:
某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:

