题目内容
8.请把空气从-只集气瓶转移到另一只集气瓶中,写出设计方法(提供用品:两个集气瓶、注射器、带导管的橡胶塞、水槽、水)分析 利用排空气和排水法来收集气体分析解答.
解答 解:可将其中一个集气瓶灌满水,倒置与水槽中,另一个装有空气的集气瓶塞上带导管的橡皮塞,然后将两个集气瓶用导管连接起来,用注射器吸水后,注射入盛有空气的集气瓶内,会看到倒置与水槽中的集气瓶内水面下降,当看到该集气瓶的水完全排出后,即已经收集满了.
点评 本题考查了气体的排出和收集方法,属于基本实验技能的内容,难度不大.

练习册系列答案
相关题目
1.某校化学小组在研究燃烧的条件时,做了如图所示甲、乙、丙三个实验,你认为该实验不能说明的是( )


| A. | 白磷能够燃烧的是实验是丙 | |
| B. | 对比实验乙和丙可以得到的结论是:可燃物燃烧温度需要达到着火点 | |
| C. | 对比实验甲和乙可以得到的结论是:可燃物燃烧需要与氧气接触 | |
| D. | 通过研究燃烧的条件可知:燃烧的三个条件缺一不可 |
2.常温下,将下列物质各5g分别溶于95g水中,充分混合,所得溶液中溶质质量分数最小的是( )
| A. | Na2CO3•10H2O | B. | CuSO4 | C. | CaO | D. | SO3 |
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
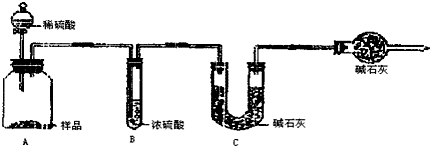
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.

甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
17.利用无色酚酞试液可以鉴别的一组溶液是( )
| A. | 氯化钡 硫酸 盐酸 | B. | 氢氧化钠 氢氧化钾 盐酸 | ||
| C. | 碳酸钾 碳酸钠 盐酸 | D. | 氯化钠 氢氧化钠 盐酸 |
18.能准确描述水的物理性质的是( )
| A. | 水不能燃烧 | B. | 在标准状况下,水在4℃时密度最大 | ||
| C. | 水的沸点是100℃ | D. | 水电解可得到两种气体 |
 小李组装了如图所示的实验装置,小试管里装有等量的粉状碳酸钙和块状碳酸钙,胶头滴管里装着相同浓度和体积的稀盐酸,实验开始时,将滴管中的稀盐酸同时加入到小试管中,观察实验现象.
小李组装了如图所示的实验装置,小试管里装有等量的粉状碳酸钙和块状碳酸钙,胶头滴管里装着相同浓度和体积的稀盐酸,实验开始时,将滴管中的稀盐酸同时加入到小试管中,观察实验现象.