题目内容
2.一包白色粉末由硫酸铜、碳酸钙、氯化钡、硫酸钠、氢氧化钠中的两种或两种以上混合而成,为探究其组成,进行以下实验:①取一定量的白色粉末加入足量的水并充分搅拌,过滤,得到白色沉淀Ⅰ和无色滤液Ⅰ.则原白色粉末中一定不含有CuSO4.
②在白色沉淀Ⅰ中加入足量稀盐酸,白色沉淀Ⅰ全部溶解,得到无色气体和无色溶液,则白色粉末中一定含有CaCO3.
根据上述实验可推断:原白色粉末的组成有5种可能.
为进一步探究原白色粉末的组成,取实验1得到的滤液,向其中通入CO2,产生白色沉淀,则可推断原白色粉末中一定还含有BaCl2和NaOH.
分析 根据硫酸铜溶于水得到蓝色溶液,而本题中得到是无色的溶液,所以在混合物中一定不含硫酸铜,同时能形成白色沉淀的为碳酸钙,硫酸钠和氯化钡也可以反应生成白色沉淀,而白色沉淀能全部溶于稀硝酸,硫酸钠和氯化钡反应生成的硫酸钡不溶于稀硝酸,所以该沉淀为碳酸钙,即硫酸钠可以氯化钡最多含有一种,可以据此分析判断并解答该题.
解答 解:①把白色粉末溶解后得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶于水会使溶液变蓝;
②实验①中的白色固体可能是碳酸钙,也可能是硫酸钠与氯化钡反应后生成的硫酸钡沉淀,但是硫酸钡不溶于水而且不溶于酸,而题目中的白色沉淀全部溶于稀盐酸中,并产生无色气体,说明这种白色沉淀是碳酸钙;由实验②可以分析出硫酸钠和氯化钡只能存在一种,或者都不存在,所以根据①和②的条件可以得出可能组合为:①CaCO3 BaCl2 ②CaCO3 BaCl2 NaOH③CaCO3 Na2SO4④CaCO3 Na2SO4 NaOH ⑤CaCO3 NaOH 故有5种可能;
通入二氧化碳后产生了白色沉淀,根据题给条件这种白色沉淀只能是碳酸钡,但是二氧化碳不能与氯化钡反应生成沉淀,从而我们判断还应该有氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠后,碳酸钠与氯化钡反应生成了碳酸钡沉淀,故推断原白色粉末中还含有物质的BaCl2和NaOH;
故答案为:
①CuSO4;②CaCO3;5;BaCl2和NaOH.
点评 本题属于文字叙述型推断题,在给定的物质范围和实验现象,来推出混合物中一定存在、一定不存在和可能存在的是什么物质;解答时以文字信息为序,寻找并抓住“题眼”,逐步分析“筛选”最终得出答案即可.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
12.在一个大萝卜上挖个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同温度下,发现倒出的溶液还能溶解少量的食盐,这说明倒出的溶液( )
| A. | 还是该温度下的饱和溶液 | B. | 是该温度下的不饱和溶液 | ||
| C. | 实验的溶解度变大了 | D. | 食盐的溶解度变小了 |
10.某同学加热氯酸钾与二氧化锰的混合物16.5g制取氧气,加热过程中测得试管内剩余固体物质的质量随时间变化如表所示:
请计算:
(1)该同学制得氧气的质量为多少?
(2)加热到5min时剩余固体中氯化钾的质量为多少?
| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 剩余固体物质的质量/g | 15.9 | 14.6 | 12.2 | 11.7 | 11.7 | 11.7 |
(1)该同学制得氧气的质量为多少?
(2)加热到5min时剩余固体中氯化钾的质量为多少?
17.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去二氧化碳中的少量一氧化碳 | 通过过量灼热的氧化铜 |
| B | 除去氢氧化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
| C | 检验二氧化碳气体 | 插入燃着的小木条,小木条熄灭是二氧化碳 |
| D | 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 | 各取少量溶液于试管中,分别滴加无色酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.化学小组的同学探究二氧化碳和氢氧化钠的反应,实验方案如下:•
(1)步骤①中气球鼓起的原因可能是NaOH溶液吸收了CO2,导致瓶内压强减小.
(2)步骤②中的操作是向外拉注射器3,其目的是证明步骤1中将瓶内的CO2全部吸收了.
(3)步骤①中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(4)本实验的结论是CO2能和NaOH发生反应.
| 实验装置 | 实验步骤及操作 | 实验现象 |
 | ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
| ②向外拉注射器3 | 无明显现象 | |
| ③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
| ④向外拉注射器3 | 澄清石灰水变浑浊 |
(2)步骤②中的操作是向外拉注射器3,其目的是证明步骤1中将瓶内的CO2全部吸收了.
(3)步骤①中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(4)本实验的结论是CO2能和NaOH发生反应.
9.某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签(如右表所示).他从瓶中倒出100毫升用于配制成稀硫酸,问
(1)这100毫升浓硫酸的质量为184克,其中含溶质硫酸180.32克.
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
| 浓硫酸(H2SO4)500毫升 | |
| 浓度(质量分数) | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
6.用如图所示装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是( ) 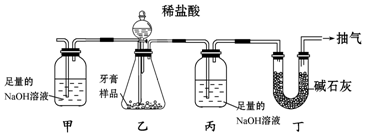

| A. | 省去装置甲和丁 | |
| B. | 将丙中的NaOH溶液换成Ca(OH)2溶液 | |
| C. | 滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2 | |
| D. | 装置乙不再产生气泡时,立即停止抽气 |

