题目内容
14. “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下反应生成氯化亚铁:
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品放入试管中,滴加一定量的 稀盐酸,用带导管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中 | 试管中固体逐渐溶解,有大量气泡产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有 Fe、CaCO3, 不含Fe2O3. |
| ②取少量样品放入试管中,加水,静置向上层清液中滴加无色酚酞试液 | 放出大量的热量,试管底部有不溶物,酚酞试液由无色变为红色. | 样品中含有 氧化钙或氢氧化钙或二者都有. |
为进一步确定这包久置的“双吸剂”固体的成分迸行如下定量实验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照下图流程进行实验:
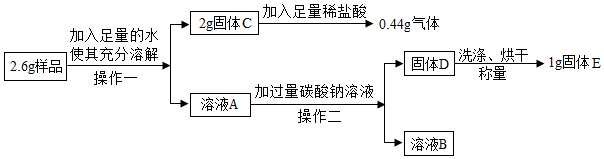
(1)操作一、操作二为相同的操作,该操作为过滤;
(2)固体C的成分是CaCO3和Fe2O3(填化学式,下同);
(3)溶液A中加入碳酸钠溶液反应方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,检验所加碳酸钠溶液是否过量的方法是:静置向上层清夜中加Na2CO3溶液(或碳酸钾溶液),若无沉淀生成,则已过量;
(4)确定固体E是否洗涤干净的方法是:取最后一次洗涤液加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净;
(5)依据实验探究1、2中现象的分析及数据计算判断出这包久置“双吸剂”固体的成分是Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验反思】下列对实验探究1、2的反思,不正确的是D(填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2溶液B中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量稀盐酸有4个反应发生.
分析 【实验探究1】从实验现象产生的原因去分析解答;
【实验质疑】从实验结论中的物质加水后发生的反应去分析解答;
【实验探究2】(1)过滤可以将固体与液体分开;
(2)根据方程式的质量比分析;
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;
(4)从每一过程中剩余的物质及物质发生的反应去分析解答;
【实验反思】
A、对物质成分的探究有时需要定性与定量实验的结合;
B、从加入的是过量的碳酸钠溶液,因此里面的溶质还有Na2CO3去分析解答;
C、从实验探究1、2实验中生成的气体成分去分析解答;
D、从久置“双吸剂”固体的成分去分析解答.
解答 解:【实验探究1】由题目中可知固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,由表中实验现象:“试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊.”说明固体和一种物质反应生成了二氧化碳气体(澄清石灰水变浊的气体),和一种含有Fe2+的物质(得到浅绿色溶液),实验室里制取二氧化碳气体的方法为用石灰石和稀盐酸反应,其化学方程式式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,而铁也可以和稀盐酸反应生成氯化亚铁和氢气,其化学方程式为:Fe+2HCl═FeCl2+H2↑,可以推出加入的这种物质为稀盐酸,固体物质中一定有的物质是Fe和CaCO3;其他的固体物质中可以和稀盐酸反应的有:①氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应化学方程式为:CaO+2HCl═CaCl2+H2O;②氢氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;③氧化铁和盐酸反应生成氯化铁(溶液为黄色)和水,其反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.由于最后所得溶液没有显黄色,也就是溶液中没有,所以固体物质中一定没有Fe2O3.
故答案为:稀盐酸;Fe和CaCO3;
加水溶解后,氧化钙可和和水反应生成氢氧化钙,同时反应放出大量的热,生成的氢氧化钙的溶液呈碱性,能使无色的酚酞试液变成红色;
故答案为:氧化钙或氢氧化钙或二者都有;
【实验质疑】由于氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁;
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2;
【实验探究2】(1)过滤可以将固体与液体分开,故答案为:过滤;
(2)取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,所以已经出去了铁粉,溶解过滤的固体Ⅰ的质量为2g,其中含有碳酸钙还可能有氧化铁,由碳酸钙与盐酸反应方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
由于生成气体0.44g所以固体Ⅰ中含有1g碳酸钙,所以固体Ⅰ中含有碳酸钙和氧化铁,
故答案为:CaCO3和Fe2O3
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
故答案为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)确定固体E是否洗涤干净的方法是:取最后一次洗涤液加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净;
【反思与评价】
A、对物质成分的探究有时需要定性与定量实验的结合;故A正确;
B、由分析中可知实验中氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,溶质有NaOH,由于加入的是过量的碳酸钠溶液,因此里面的溶质还有Na2CO3,故B正确;
C、由实验探究1可知实验中产生的气体为氢气和二氧化碳气体两种,由实验探究2可知实验中产生的气体为二氧化碳气体所以生成的气体成分不同;故C正确;
D、由固体物质的成分为:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3;最起码五种物质都与盐酸反应,反应个数多于5个;故D错误;
故答案为:D
答案:
【实验探究1】
稀盐酸; Fe、CaCO3;氧化钙或氢氧化钙或二者都有;
【实验质疑】
Fe2O3+6HCl═2FeCl3+3H2O; Fe+2FeCl3═3FeCl2;
【实验探究2】
(1)过滤;
(2)CaCO3、Fe2O3
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;向上层清夜中加Na2CO3溶液(或碳酸钾溶液),若无沉淀生成,则已过量;
(4)加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净(合理即可)
(5)D
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

 阅读快车系列答案
阅读快车系列答案| 物质 | 杂质 | 除杂质的方法 | |
| A | CuO | Cu | 加入过量的稀盐酸,过滤 |
| B | FeCl3溶液 | CuCl2溶液 | 加入过量的铁粉,过滤 |
| C | CO2气体 | HCl气体 | 通过氢氧化钠溶液的洗气瓶 |
| D | KOH溶液 | K2CO3溶液 | 加入适量的氢氧化钙溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】
(1)该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 化学式 | 颜色、状态 | 溶解性 | 熔点(℃) | 密度(g/cm3) |
| 草酸 | H2C2O4 | - | 易溶于水 | 189.5 | 1.900 |
| 草酸晶体 | H2C2O4•2H2O | 无色晶体 | - | 101.5 | 1.650 |
【作出猜想】
第一种:草酸分解产物CO2和H2
第二种:草酸分解产物是CO2、CO和H2O
第三种:草酸的分解产物是CO2、H2O(你猜想的产物化学式)
【设计实验】

【实验操作】甲同学按其设计的实验装置(如图1)实验时观察到澄清的石灰水变浑浊了乙同学按图2的装置实验也观察到澄清的石灰水变浑浊了,这些现象证明产物中一定有CO2; 无水CuSO4变蓝,证明产物中还有H2O若产物中有CO,则乙的对应实验现象是点燃干燥管上方的气体,可以燃烧,烧杯内壁的澄清石灰水变浑浊证明CO生成的化学反应方程式是2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、CO2+Ca(OH)2═CaCO3↓+H2O
【得出结论】若第二种猜想是正确的,请你写出草酸分解的反应方程式
H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O.
【反思评价】乙认为甲设计的实验装置有缺陷:由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验.请你谈谈装置2的至少两点优于装置1的优点:
防止熔化的草酸流出;图2装置可以检验出生成物中是否有水蒸气;图2装置可以检验出生成物中是否有一氧化碳;图2装置可以检验出生成物中是否有氢气.
利用乙设计的装置证明产物中没有H2的方法是:在干燥管上方罩一干冷烧杯,点燃气体,观察烧杯内壁无水珠出现
【交流讨论】丙同学继续查阅相关资料发现:草酸是一种酸,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物.丙同学通过进一步研究,对实验中CO2的检验提出质疑,并提出实验的改进措施,他提出的措施是在装置之间加一个冷却装置(塞有双孔橡皮塞的试管或广口瓶等)或盛有水的洗气瓶.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想三,理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 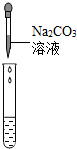 | 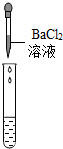 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中.
②实验方案中也有一个是错误的,错误的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.




