题目内容
6.石灰石样品的主要成分是碳酸钙(已知其他杂质不与盐酸反应),课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象: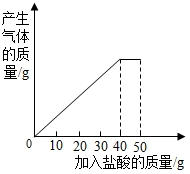
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
(1)完全反应后产生二氧化碳的质量;
(2)石灰石样品中CaCO3的纯度.
分析 由图象可知,加入40g盐酸时恰好反应,每10g盐酸反应掉4g碳酸钙,故加入40g盐酸时反应掉16g碳酸钙,剩余固体的质量为4g,即为杂质的质量;
由杂质的质量可知碳酸钙的质量,根据化学方程式利用碳酸钙的质量计算出生成二氧化碳的质量即可.
解答 解:由图象可知,加入40g盐酸时恰好反应,每10g盐酸反应掉4g碳酸钙,故加入40g盐酸时反应掉16g碳酸钙,剩余固体的质量为4g,即为杂质的质量.其中碳酸钙的质量为:20g-4g=16g,石灰石样品中碳酸钙的质量分数为:$\frac{16g}{20g}×100%=80%$.
设生成二氧化碳的质量为x,则
CaCO3+2HC1═CaCl2+CO2↑+H2O
100 44
16g x
$\frac{100}{44}=\frac{16g}{x}$
x=7.04g
答:(1)完全反应后生成二氧化碳的质量为7.04g;(2)石灰石样品中CaCO3的纯度为80%.
点评 根据数据列表或关系图,找出反应中某物质的质量是这一类问题的解决方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.小明在厨房里利用闻气味的方法就把一瓶已失去标签的陈醋和一瓶酱油区分开,你认为小明的这种做法属于科学探究中的( )
| A. | 猜想假设 | B. | 交流评价 | C. | 进行实验 | D. | 得出结论 |
9.下列有关水说法正确的是( )
| A. | 水(H2O)和过氧化氢(H2O2)分子中都含有氢气分子 | |
| B. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 | |
| C. | 水通电时分解生成氢气和氧气的质量比为2:1 | |
| D. | 水加热变成水蒸气,水分子的质量和水分子的种类都没发生改变 |
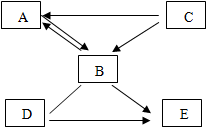 已知A和C的组成元素相同,C在二氧化锰的催化下可以得到可以供给呼吸的气体B和无色液体A.固体D在纯净的B中剧烈燃烧,火星四射,生成黑色固体E.回答下列问题
已知A和C的组成元素相同,C在二氧化锰的催化下可以得到可以供给呼吸的气体B和无色液体A.固体D在纯净的B中剧烈燃烧,火星四射,生成黑色固体E.回答下列问题