题目内容
20.除去物质中混有的少量杂质,下列各项所选试剂及操作方法不正确的是( )| 序号 | 物质 | 杂质(少量) | 试剂和操作方法 |
| A | FeSO4溶液 | CuSO4溶液 | 加入足量铁粉,过滤 |
| B | NaCl溶液 | Na2CO3溶液 | 加入适量BaCl2溶液,过滤 |
| C | 铁粉 | 铜粉 | 加入足量稀硫酸,过滤 |
| D | CaCl2溶液 | 盐酸 | 加入足量石灰石,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、足量铁粉能与CuSO4溶液反应生成硫酸亚铁溶液和铜,再进行过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法错误.
B、Na2CO3溶液能与适量BaCl2溶液反应生成碳酸钡沉淀和氯化钠,再进行过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法错误.
C、铁粉能与稀硫酸反应生成硫酸亚铁溶液和氢气,铜不与稀硫酸反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法正确.
D、盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法错误.
故选:C.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
10.下列物质中,前者属于纯净物,后者属于混合物的是( )
| A. | 净化后的空气、二氧化硫 | |
| B. | 液氮、啤酒 | |
| C. | 生锈的铁钉、高锰酸钾加热后的剩余固体 | |
| D. | 氯化钾、五氧化二磷 |
11. “家”是一个化学小世界,蕴含丰富的化学知识.
“家”是一个化学小世界,蕴含丰富的化学知识.
(1)分析下列与食品有关的物质,回答问题:
①碳酸饮料中常加入防腐剂--苯甲酸(C6H5COOH).该防腐剂属于有机物(填“有机物”或“无机物”).
②常用的食品干燥剂--生石灰(如图),其干燥吸水的原理是CaO+H2O═Ca(OH)2(用化学方程式表示).
分析图中“不可食用”的原因是氧化钙和水反应放出大量热,灼伤食道;或生成的氢氧化钙有腐蚀性(写一点).
(2)下表为几种家用清洁剂的功能及有效成分:
①不宜用“洁厕灵”清洗大理石地面的原因是CaCO3+2HCl=CaCl2+H2O+CO2↑(用化学方程式表示).
欲测定“洁厕灵”的酸碱度,可选用A(填标号).
A.pH试纸 B.酚酞溶液 C.石蕊溶液
②往“活氧彩漂”液体中加入少量二氧化锰,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)氨水(NH3•H20 )属于碱(填“酸”“碱”“盐”),写出氨水与硫酸反应的化学方程式2NH3•H20+H2SO4=(NH4)2SO4+2H2O.
 “家”是一个化学小世界,蕴含丰富的化学知识.
“家”是一个化学小世界,蕴含丰富的化学知识.(1)分析下列与食品有关的物质,回答问题:
①碳酸饮料中常加入防腐剂--苯甲酸(C6H5COOH).该防腐剂属于有机物(填“有机物”或“无机物”).
②常用的食品干燥剂--生石灰(如图),其干燥吸水的原理是CaO+H2O═Ca(OH)2(用化学方程式表示).
分析图中“不可食用”的原因是氧化钙和水反应放出大量热,灼伤食道;或生成的氢氧化钙有腐蚀性(写一点).
(2)下表为几种家用清洁剂的功能及有效成分:
| 名 称 | 洁厕灵 | 活氧彩漂 | 漂白精 |
| 功 能 | 有效清除污垢与异味 | 漂洗使衣物色彩鲜艳 | 快速漂除衣物污渍 |
| 有效成分 | HCl | H2O2 | NaClO |
欲测定“洁厕灵”的酸碱度,可选用A(填标号).
A.pH试纸 B.酚酞溶液 C.石蕊溶液
②往“活氧彩漂”液体中加入少量二氧化锰,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)氨水(NH3•H20 )属于碱(填“酸”“碱”“盐”),写出氨水与硫酸反应的化学方程式2NH3•H20+H2SO4=(NH4)2SO4+2H2O.
8.甲酸(HCOOH)俗称蚁酸,能刺激皮肤起泡,存在于蜂类、某些蚁类和毛虫的分泌物中.某校兴趣小组同学对甲酸进行研究,并进行一氧化碳还原氧化铁的实验.
【查阅资料】
①甲酸的酸性比醋酸强,具有酸的通性.
②甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解.甲酸分解的化学方程式为:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,浓硫酸在反应中起脱水作用.
③铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【实验设计及操作】
I.验证甲酸的酸性,完成实验记录:
Ⅱ.利用下列图1装置,以甲酸为原料制备纯净、干燥的一氧化碳,完成一氧化碳还原氧化铁实验,并检验气态产物.
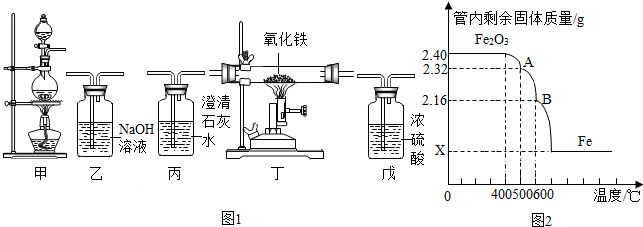
①实验前应先组装好仪器,并检查装置的气密性,再装入药品.若各步均反应完全,装置的连接顺序为甲→乙→戊→丁→丙(填序号).从环保角度,连接好的装置还存在明显不足,请改进加装尾气处理装置.
②实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是产生CO气体,排尽装置内的空气,防止加热爆炸;装置乙能否去除不能(选填“能”、“不能”),你的理由是如果不除去CO中的甲酸气体,甲酸气体会与氧化铁以及石灰水反应.
③装置丁中观察到的现象是红色的氧化铁粉末逐渐变为黑色;装置丙中发生反应的化学方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 .
④为检验氧化铁是否反应完全,同学们设计如下实验方案:从装置丁中取出少量反应后的固体粉末于试管中,加入足量稀盐酸,若观察到有大量气泡产生且溶液变为浅绿色而非黄色,则说明氧化铁已完全反应.上述判断是否正确,理由是不正确,未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色.
Ⅲ.已知在不同的温度下,CO与氧化铁反应能生成其它铁的氧化物(或铁单质)和CO2.反应过程中丁中管内的固体质量随温度的变化曲线如图2.
利用图2显示的相关信息,回答如下问题.
①在0~400℃温度范围内,管内固体质量不变,其原因是未达到反应所需的最低温度.
②图中x=1.68g.
③试据图计算并推断B点固体的合理化学式FeO.
④写出在温度500~600℃内,丁装置中发生反应的化学方程式Fe3O4+CO$\frac{\underline{\;高温\;}}{\;}$3FeO+CO2 .
【查阅资料】
①甲酸的酸性比醋酸强,具有酸的通性.
②甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解.甲酸分解的化学方程式为:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,浓硫酸在反应中起脱水作用.
③铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【实验设计及操作】
I.验证甲酸的酸性,完成实验记录:
| 操作 | 实验现象 | 原理或解释 | |
| 取 甲 酸 溶 于 水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含氢离子 |
| 加适量的锌粒 | 观察到有气泡冒出 | 2HCOOH+Zn═(HCOO)2Zn+H2↑ | |
| 加氧化铁粉末 | 观察到红棕色固体消失,溶液变成黄色 | 甲酸可以与金属氧化物反应,工业上 可用甲酸除锈 |

①实验前应先组装好仪器,并检查装置的气密性,再装入药品.若各步均反应完全,装置的连接顺序为甲→乙→戊→丁→丙(填序号).从环保角度,连接好的装置还存在明显不足,请改进加装尾气处理装置.
②实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是产生CO气体,排尽装置内的空气,防止加热爆炸;装置乙能否去除不能(选填“能”、“不能”),你的理由是如果不除去CO中的甲酸气体,甲酸气体会与氧化铁以及石灰水反应.
③装置丁中观察到的现象是红色的氧化铁粉末逐渐变为黑色;装置丙中发生反应的化学方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 .
④为检验氧化铁是否反应完全,同学们设计如下实验方案:从装置丁中取出少量反应后的固体粉末于试管中,加入足量稀盐酸,若观察到有大量气泡产生且溶液变为浅绿色而非黄色,则说明氧化铁已完全反应.上述判断是否正确,理由是不正确,未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色.
Ⅲ.已知在不同的温度下,CO与氧化铁反应能生成其它铁的氧化物(或铁单质)和CO2.反应过程中丁中管内的固体质量随温度的变化曲线如图2.
利用图2显示的相关信息,回答如下问题.
①在0~400℃温度范围内,管内固体质量不变,其原因是未达到反应所需的最低温度.
②图中x=1.68g.
③试据图计算并推断B点固体的合理化学式FeO.
④写出在温度500~600℃内,丁装置中发生反应的化学方程式Fe3O4+CO$\frac{\underline{\;高温\;}}{\;}$3FeO+CO2 .
15.根据所学化学知识和生活经验判断,下列变化属于物理变化的是( )
| A. | 烟花绽放 | B. | 蜡烛燃烧 | C. | 海水晒盐 | D. | 葡萄酿酒 |
9.某化学兴趣小组的同学在老师的指导下,设计了如图所示的实验装置进行实验和探究.请回答有关问题:

(1)请写出图中标有字母的仪器名称:a试管. b长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应该选择的气体发生装置是A(填序号,下同)反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气.若实验时用过氧化钠和水反应来制取并收集一瓶较纯净的氧气,应选用的装置是B、C.
(4)通过以上实验,你觉得选择气体发生装置应考虑的因素是反应物的状态和反应条件.
小强、小宇和小红对实验探究产生了浓厚的兴趣,他们用装置A做碳还原氧化铜的实验.为了集中火焰并提高反应温度,你给装置A中的加热仪器提出的改进方法是在酒精灯上加一个金属网罩.充分反应后,他们对试管内的剩余固体展开探究.
提出问题 试管内剩余固体是什么?
猜想与假设 猜想一:小强认为剩余固体是铜
猜想二:小宇认为剩余固体是铜和碳的混合物
猜想三:小红认为剩余固体是铜和氧化铜的混合物
实验探究
(1)他们将冷却后的固体放在白纸上,观察到其中仍有少许黑色固体存在,证明猜想一不成立.
(2)请你和小红一起设计实验来验证小红的猜想

(1)请写出图中标有字母的仪器名称:a试管. b长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应该选择的气体发生装置是A(填序号,下同)反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气.若实验时用过氧化钠和水反应来制取并收集一瓶较纯净的氧气,应选用的装置是B、C.
(4)通过以上实验,你觉得选择气体发生装置应考虑的因素是反应物的状态和反应条件.
小强、小宇和小红对实验探究产生了浓厚的兴趣,他们用装置A做碳还原氧化铜的实验.为了集中火焰并提高反应温度,你给装置A中的加热仪器提出的改进方法是在酒精灯上加一个金属网罩.充分反应后,他们对试管内的剩余固体展开探究.
提出问题 试管内剩余固体是什么?
猜想与假设 猜想一:小强认为剩余固体是铜
猜想二:小宇认为剩余固体是铜和碳的混合物
猜想三:小红认为剩余固体是铜和氧化铜的混合物
实验探究
(1)他们将冷却后的固体放在白纸上,观察到其中仍有少许黑色固体存在,证明猜想一不成立.
(2)请你和小红一起设计实验来验证小红的猜想
| 实验步骤 | 实验现象 | 实验结论 |
| 取少许剩余固体于试管中,加入一定量的稀盐酸(或稀硫酸),加热并观察现象. | ①试管内黑色固体逐渐消失,仍有红色固体存在. ②溶液由无色变成蓝色 | 小红的猜想正确 |
10.下列关于分子的说法中,错误的是( )
| A. | 分子是保持物质化学性质的最小粒子 | |
| B. | 物质能呈三态,是由于分子间有一定的间隔 | |
| C. | 单质就是由同种分子构成的物质 | |
| D. | 同种物质的分子性质相同,不同种物质的分子性质不同 |
