题目内容
4.如图所示是气体制取与性质验证的组合实验.打开A中分液漏斗活塞后,A、B、C、D、E中均可观察到明显现象.
(1)A中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)B中的现象是白磷燃烧.
(3)A中产生的氧气在C装置中有何作用③.
①供给呼吸 ②使带火星的木条复燃 ③将稀盐酸压入D装置中
(4)E中的现象是紫色石蕊溶液变红色,产生此现象的原因是CO2+H2O=H2CO3(用化学方程式表示).
(5)用F装置收集气体,说明该气体具有的性质是密度比空气的大.
分析 (1)根据过氧化氢与二氧化锰接触会生成氧气进行分析;
(2)根据可燃物燃烧的条件进行分析;
(3)根据装置的特点分析回答;
(4)根据二氧化碳与水反应会生成碳酸进行分析;
(5)根据气体的收集装置进行分析.
解答 解:(1)双氧水在二氧化锰的催化作用下会生成水和氧气,发生反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)A中生成的氧气和白磷接触,在热水中白磷的温度达到着火点,就能燃烧,所以B中的现象是白磷燃烧;
(3)由装置的特点可知,A中产生的氧气在C装置中将稀盐酸压入D装置中;
(4)盐酸和碳酸钙生成的二氧化碳与水反应生成碳酸,碳酸具有酸性,会使紫色石蕊变红色,反应的化学方程式是:CO2+H2O=H2CO3;
(5)F装置集气瓶口朝上,可以将空气从从上面排出收集气体,说明该气体具有的性质是密度比空气的大.
故答为:(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(2)白磷燃烧;(3)③;(4)紫色石蕊溶液变红色,CO2+H2O=H2CO3;(5)密度比空气的大.
点评 在解此类题时,首先分析题目考查的要点,然后结合学过的知识进行分析,在书写方程式时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.我们生活在不断变化的物质世界中,下列变化属于物理变化的是( )
| A. | 蜡烛的燃烧 | B. | 二氧化碳使澄清石灰水变浑浊 | ||
| C. | 铁钉在潮湿的空气中生锈 | D. | 直饮水机中活性炭吸附杂质 |
15.已知某金属粉末中除含有Al外还含有一定量的Fe,为测定金属的含量,某化学兴趣小组的同学展开了如下的实验探究.
小资料:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:
2Al+2H2O+2NaOH═2NaAlO2+3H2↑,Fe不与氢氧化钠溶液反应).
取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据如下:
(1)第四次加入NaOH后,溶液中的溶质是氢氧化钠和偏铝酸钠;
(2)Fe的质量分数为30%;
(3)第三次加入氢氧化钠溶液后,共生成多少克氢气?所用氢氧化钠溶液的溶质质量分数为多少?(精确到0.1%)
小资料:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:
2Al+2H2O+2NaOH═2NaAlO2+3H2↑,Fe不与氢氧化钠溶液反应).
取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 剩余固体的质量/g | 16.4 | 12.8 | 9.2 | 6 | m |
(2)Fe的质量分数为30%;
(3)第三次加入氢氧化钠溶液后,共生成多少克氢气?所用氢氧化钠溶液的溶质质量分数为多少?(精确到0.1%)
12.下列现象和应用中,所包含的主要变化有一项与其他三项有本质区别,该项是( )
| A. | 黄豆霉变 | |
| B. | 酸雨腐蚀铁制栏杆 | |
| C. | 利用熟石灰改良酸性土壤 | |
| D. | 利用沸点不同分离液态空气制得氧气 |

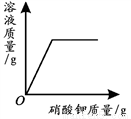 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
一定温度下,向不饱和硝酸钾溶液中加入硝酸钾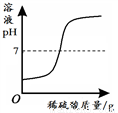 向一定量NaOH溶液中加入稀H2SO4
向一定量NaOH溶液中加入稀H2SO4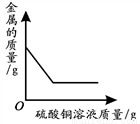 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液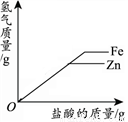 向相同质量的锌粉和铁粉中,分别加入足量的稀盐酸
向相同质量的锌粉和铁粉中,分别加入足量的稀盐酸