题目内容
9.在Cu(NO3)2、Zn(NO3)2和AgNO3的混合溶液中,加入一定量的镁粉,使之充分反应后,溶液变为无色,将溶液过滤,所得固体物质加稀盐酸有气泡产生,则下列说法正确的是( )| A. | 反应后固体物质的组成中一定有银、铜、镁,可能有锌 | |
| B. | 向滤液中滴加NaCl溶液,可能与不溶于稀HNO3的白色沉淀生成 | |
| C. | 反应后固体物质中一定有银、铜、锌、镁 | |
| D. | 滤液中一定含有Mg2+,可能含有Zn2+ |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.加入一定量的镁粉,充分反应后,溶液变为无色,说明硝酸铜中的铜完全被置换出来;向滤出的固体中滴加稀盐酸,有气泡产生,说明固体中有锌,甚至有未反应完的镁粉.
解答 解:A、向滤出的固体中滴加稀盐酸,有气泡产生,说明固体中有锌,甚至有未反应完的镁粉,因此反应后固体物质的组成中一定有银、铜、锌,可能有镁,故错误.
B、加入一定量的镁粉,充分反应后,溶液变为无色,说明硝酸铜中的铜完全被置换出来,那么硝酸银中银已被置换完毕,所以向滤液中滴加NaCl溶液,不可能有不溶于稀HNO3的白色沉淀生成,故错误.
C、向滤出的固体中滴加稀盐酸,有气泡产生,说明固体中有锌,甚至有未反应完的镁粉,因此反应后固体物质的组成中一定有银、铜、锌,可能有镁,故错误.
D、向滤出的固体中滴加稀盐酸,有气泡产生,说明固体中有锌,甚至有未反应完的镁粉,因此滤液中一定含有Mg2+,镁粉没有将Zn2+置换完时溶液中有Zn2+,镁粉过量时溶液中没有Zn2+,故正确.
故选D.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目
19.下列关于“盐”的说法中,不正确的是( )
| A. | “请往菜中加点盐”中的“盐”特指食盐(NaCl) | |
| B. | 化学上所说的盐就是指生活中作调味品的食盐 | |
| C. | 化学上所说的盐指的是一类物质的总称 | |
| D. | 食盐每天摄入量不能太多,否则不利于健康 |
4.下列实验现象描述正确的是( )
| A. | 氢气在空气中燃烧产生淡蓝色火焰 | |
| B. | 红磷在空气中燃烧,产生白雾 | |
| C. | 铁在纯氧中剧烈燃烧、火星四射,生成四氧化三铁 | |
| D. | 木炭在氧气中完全燃烧,生成能使澄清石灰水变浑浊的二氧化碳气体 |
14. 已知如图为某粒子的结构示意图,下列说法正确的是( )
已知如图为某粒子的结构示意图,下列说法正确的是( )
 已知如图为某粒子的结构示意图,下列说法正确的是( )
已知如图为某粒子的结构示意图,下列说法正确的是( )| A. | 该元素位于第三周期 | |
| B. | 该元素在化合物中常显+1价 | |
| C. | 该元素的一个离子含有17个电子 | |
| D. | 该元素的原子在化学反应中容易失去电子 |
1.最近科学家发现,水在-157℃超低温、正常压力或真空集条件下仍呈液态,比蜂蜜还粘稠,下列关于这种“高密度液态水”的说法正确的是( )
| A. | 化学性质与普通水不同 | B. | 分子不再运动 | ||
| C. | 分子间的间隔比普通水大 | D. | 氢、氧两种原子的个数比为2:1 |
10.碳酸镁晶须(MgCO3•nH2O,n=1-5的整数)广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行实验:(不考虑稀盐酸挥发)
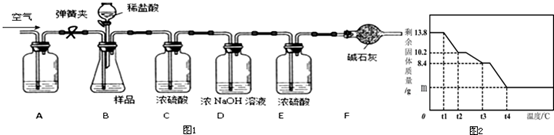
【查阅资料】:碳酸镁晶须受热分解,生成3种氧化物;
【实验步骤】①组装仪器,检查装置的气密性;②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;③打开弹簧夹,鼓入一段时间空气,称量B、C、D、E、F装置的质量;④关闭弹簧夹,打开分液漏斗活塞,缓缓滴入稀盐酸至无气泡产生为止;⑤打开弹簧夹,鼓入一段时间空气;
⑥准确称量B、C、D、E、F装置的质量(如下表);
⑦根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤鼓入一段时间空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是NaOH(浓)溶液;
【实验反思】
(4)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③⑥;
①反应结束后,没有通空气;②滴入稀盐酸前,没有通空气;③没有A装置; ④D装置中NaOH溶液浓度过大;⑤稀盐酸滴加速率太快; ⑥没有C装置;
(5)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:
①t1℃至t2℃时,剩余固体质量不变的原因为没有达到该晶分解需要的温度;
②t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O═MgCO3•H2O+2H2O;
③完全反应后,剩余固体的质量m为4g.

【查阅资料】:碳酸镁晶须受热分解,生成3种氧化物;
【实验步骤】①组装仪器,检查装置的气密性;②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;③打开弹簧夹,鼓入一段时间空气,称量B、C、D、E、F装置的质量;④关闭弹簧夹,打开分液漏斗活塞,缓缓滴入稀盐酸至无气泡产生为止;⑤打开弹簧夹,鼓入一段时间空气;
| B | C | D | E | F | |
| 反应前 | 122.0g | 250.0g | 300.0g | 350.0g | 330.0g |
| 反应后 | 120.6g | 250.2g | 301.0g | 350.1g | 332.0g |
⑦根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤鼓入一段时间空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是NaOH(浓)溶液;
【实验反思】
(4)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③⑥;
①反应结束后,没有通空气;②滴入稀盐酸前,没有通空气;③没有A装置; ④D装置中NaOH溶液浓度过大;⑤稀盐酸滴加速率太快; ⑥没有C装置;
(5)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:
①t1℃至t2℃时,剩余固体质量不变的原因为没有达到该晶分解需要的温度;
②t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O═MgCO3•H2O+2H2O;
③完全反应后,剩余固体的质量m为4g.


