题目内容
9. 背景1:市场上销售的豆腐干、盐水鸭等食品,常采用真空包装.真空包装的目的是除去空气使大多数微生物因缺少氧气而受到抑制,停止繁殖,从而防止食品变质.
背景1:市场上销售的豆腐干、盐水鸭等食品,常采用真空包装.真空包装的目的是除去空气使大多数微生物因缺少氧气而受到抑制,停止繁殖,从而防止食品变质.背景2:“可比克”等膨化食品、茶叶等常采用真空充气包装,即将食品装入包装袋,抽出包装袋内的空气,再充入防止食品变质的气体,然后封口.真空充气包装能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形.
【提出问题】充入食品包装袋中的气体是什么?
【猜想假设】经过同学们的激烈讨论,最后同学们提出了气体可能三种情况:①N2、②CO2、③H2.
【提出方案】
(1)小明同学认为气体不可能是H2,因为它具有可燃性.
(2)为了继续探究气体的成分,小华和小红两位同学各提出了一种方案.
①小华方案:收集一瓶该气体,把一根燃着的木条伸入瓶中,发现木条熄灭.由此得出气体是CO2.该方案是否可行?否(是或否).理由是氮气也能使木条熄灭.
②小红的方案被同学们认可.走进食品生产工厂,在装有该气体的容器(容器内压强接近大气压强)上连接了如图一个装置.
(a)为了使容器内的气体通过澄清石灰水,活塞应向有(左或右)移动.
(b)不管气体是CO2还是N2,试管中都有的实验现象是有气泡冒出.
(c)经过实验后,发现稀有气体,证明气体是CO2.
分析 背景1、大多数的食品因为氧气的存在而发生氧化,并且大多数的微生物的生存环境中氧气是必不可少的一种气体;
(2)①从氢气具有可燃性,氮气、二氧化碳都不支持燃烧判断.
②结合物理知识中压强的改变和会出现的实验现象分析.
解答 解:背景1、大多数微生物在缺少氧气的环境中生命活动受到抑制,有机物在氧气存在的情况下容易发生缓慢氧化.
(2)因为氢气有可燃性,用做保护气会不安全;①因为氮气和二氧化碳都不支持燃烧,都能使木条熄灭,故小华的方案不可行.
(a)为了使容器内的气体通过澄清石灰水,活塞应向右移动.
(b)不管气体是CO2还是N2,试管中都有的实验现象是有气泡冒出.
(c)根据对食品中充入的气体应该无毒并且不和食物反应,同学们经过讨论后,认为该气体除了是CO2,还可能是稀有气体.
故答案为:(1)氧气;(2)可燃,①否,氮气也能使木条熄灭②(a)右(b)有气泡冒出;(c)稀有气体.
点评 本题是借助生活中常见问题来考查学生对知识的应用,可有效的训练学生知识的迁移能力和信息的抽取应用能力.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
14.下列特产制作的主要过程中涉及化学变化的是( )
| A. | 奉节脐橙榨汁 | B. | 缙云竹笋晾干 | C. | 梁平金柚酿酒 | D. | 湛江海椒磨粉 |
1. 锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
 锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )
锡是人体生命活动必需的微量元素之一,它具有促进生长发育、血红蛋白的分解、机体组织生长和创伤愈合的功能,抑制癌细胞的生成,人体如果长期缺乏锡会影响生长发育.如图是锡元素的部分信息,下列说法错误的是( )| A. | 锡元素的符号是Sn | B. | 锡原子的相对原子质量是118.7 | ||
| C. | 锡原子核外电子数是50 | D. | 锡元素属于非金属元素 |
18.根据如图水分子分解的微观示意图,得出的信息错误的是( )
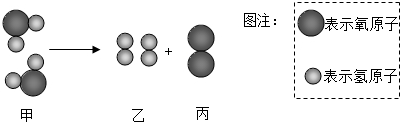

| A. | 反应前后分子的数目发生改变 | |
| B. | 反应前后分子的种类发生改变 | |
| C. | 分子是化学变化中的最小微粒 | |
| D. | 甲、乙、丙三种分子的个数比为2:2:1 |
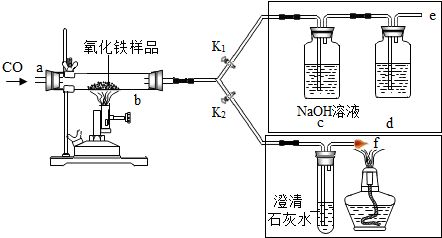
19.2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”.某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③在f处点燃气体的目的是点燃多余的一氧化碳,避免污染空气
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装D(填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是减少碳的排放,提高原料利用率
(3)小刚用不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用如图所示装置进行实验,相关实验数据见下表:(物质完全反应)
①由如表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是氧元素的质量.
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x 6.6g
则$\frac{160}{132}=\frac{x}{6.6g}$,解得x=8g.
样品中氧化铁的质量分数为$\frac{8g}{10g}$×100%=80%..
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③在f处点燃气体的目的是点燃多余的一氧化碳,避免污染空气
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装D(填序号).
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是减少碳的排放,提高原料利用率
(3)小刚用不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用如图所示装置进行实验,相关实验数据见下表:(物质完全反应)

| 编号 | 称量物 | 反应前 | 反应后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x 6.6g
则$\frac{160}{132}=\frac{x}{6.6g}$,解得x=8g.
样品中氧化铁的质量分数为$\frac{8g}{10g}$×100%=80%..
 比较、归纳是学习的重要方法,小红在学习了酸、碱、盐知识后进行了总结:
比较、归纳是学习的重要方法,小红在学习了酸、碱、盐知识后进行了总结: