题目内容
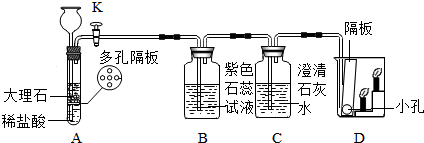
17.如图1是化学实验室制取气体的常用装置,请回答下列问题:
(1)实验室用加热高锰酸钾传体的方法制取氧气,其化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,选用气体发生装置为A(填A、B、C等字母),氧气能用F装置收集的原因是氧气不易溶于水;
(2)实验室常用锌和稀硫酸反应制取少量氢气,其反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑,收集氢气通常选用的装置为D或F(填A、B、C等字母),与B装置相比,使用带有多孔隔板和玻璃活塞的C装置制取氢气的优点是能使反应随时进行或停止;
(3)若要利用如图2所示装置收集气体,气体应从该装置的右(填“左”或“右”)边通入.
分析 (1)根据质量守恒定律和条件写化学方程式,利用反应物的状态和反应条件选择发生装置,利用气体的密度和溶解性选择收集装置;
(2)通常情况下,锌和稀硫酸反应生成硫酸锌和氢气,氢气难溶于水,密度比空气小.不同的实验装置,功能不同;
(3)根据气体的密度比水的小解答.
解答 解:
(1)根据质量守恒定律和条件写化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,发生装置的选择如果是固液常温型选择装置A,如果是固固加热型则选择装置B,因为反应物高锰酸钾是固体,反应条件是加热,所以选择的发生装置是B;氧气能用F装置收集的原因是氧气不易溶于水;
(2)实验室用锌与稀硫酸在常温下反应制取氢气,反应方程式为:Zn+H2SO4═ZnSO4+H2↑,氢气难溶于水,密度比空气小,收集氢气通常选用的装置为D或F;B装置改进为C装置,其优点是能使反应随时进行或停止,其原理是:关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;
(3)气体的密度比水的小,若要利用如图2所示装置收集气体,气体应从该装置的右边通入.
答案:
(1)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;A;氧气不易溶于水;
(2)Zn+H2SO4═ZnSO4+H2↑;F;能使反应随时进行或停止;
(3)右.
点评 本题综合考查了学生的基本实验能力,涉及仪器的用途、反应表达式的书写、装置选择、实验基本操作等知识,只有综合理解化学知识才能够正确的解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
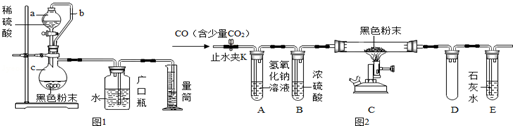
 如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其余反应条件、部分反应物已略去.试判断:
如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其余反应条件、部分反应物已略去.试判断:
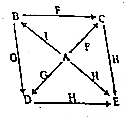 A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).
A~I是初中化学常见物质,硫酸亚铁、硫酸、硫酸钠、氧化铜、硫酸钡、氢氧化钠、铁、氯化钡、硫酸铜中的某一种,B是蓝色溶液,E是白色固体、G、I都是黑色的固体,如图是这些物质的转化关系(部分反应物、生成物及反应条件已省略).
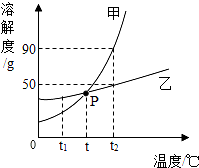 如图为甲、乙两种物质的溶解度曲线,据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线,据图回答下列问题.