题目内容
4.有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙中的一种或几种.为探究其组成进行如下实验,主要流程及现象记录如下:【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性
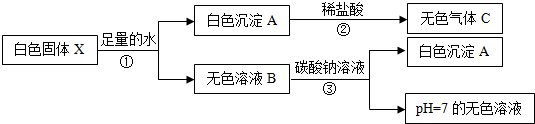
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有的物质是硫酸铜.
(2)步骤②中发生反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
(3)白色固体X中一定含有的是氯化钠、碳酸钙和氯化钙
(4)不能确定是否含有的是氢氧化钙.为了检验该物质是否存在,应怎样操作,简单写出操作过程取样品,加水溶解,滴入酚酞,溶液变红色,证明含有氢氧化钙,反之不含氢氧化钙..
分析 根据碳酸钙难溶于水,硫酸铜溶液为蓝色,再根据图框可知:得无色溶液,推测白色固体X中一定没有的物质是硫酸铜,而白色沉淀与稀盐酸反应生成无色气体,推测含有碳酸根;而步骤③中产生白色沉淀A的反应为氯化钙与碳酸钠溶液的反应进行分析.
解答 解:因为碳酸钙难溶于水,硫酸铜溶液为蓝色,再根据图框可知:得无色溶液,推测白色固体X中一定没有的物质是硫酸铜,而白色沉淀与稀盐酸反应生成无色气体,推测含有碳酸根;而步骤③中产生白色沉淀A的反应为氯化钙与碳酸钠溶液的反应,所以:
(1)根据步骤①实验现象确定白色固体X中一定没有的物质是硫酸铜;
(2)步骤②中发生的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)通过推导可知,白色固体X中的物质有:氯化钠、碳酸钙和氯化钙.
(4)题中的现象不能确定后是否含有氢氧化钙,氢氧化钙溶液显碱性,能使酚酞变红色,所以操作过程是:取样品,加水溶解,滴入酚酞,溶液变红色,证明含有氢氧化钙,反之不含氢氧化钙..
故答案为:(1)硫酸铜;
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)氯化钠、碳酸钙和氯化钙;
(4)取样品,加水溶解,滴入酚酞,溶液变红色,证明含有氢氧化钙,反之不含氢氧化钙.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演该反应的化学方程式NaOH+HCl═NaCl+H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是把pH试纸浸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是碳酸钠也能和氯化钡反应生成碳酸钡白色沉淀.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演该反应的化学方程式NaOH+HCl═NaCl+H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡生成. | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是把pH试纸浸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是碳酸钠也能和氯化钡反应生成碳酸钡白色沉淀.
19.空气中含量最多的物质是( )
| A. | 氮气 | B. | 二氧化碳 | C. | 水蒸气 | D. | 氧气 |
9.小华同学的化学复习笔记上有如下记录,你认为不正确的是( )
| A. | 燃烧一定发光、放热,一定是化学变化 | |
| B. | 有盐和水生成的反应不一定是中和反应 | |
| C. | 知道元素原子的质子数就能确定其核外电子数 | |
| D. | 某物质的饱和溶液不能再溶解其他物质 |
16.在盛有AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液的试管中,加入一定量的铁粉充分待反应完成后过滤,下列情况是可能存在的是( )
| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+ | |
| B. | 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+ | |
| C. | 滤纸上有Ag、Cu、Fe,滤液中只有Fe2+ | |
| D. | 滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+ |
13.在一个密闭容器中有X、Y、Z、Q四种物质,一定条件下充分反应,测得反应前后各物质的质量如表所示:下列说法中不正确的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 4 | 10 | 1 | 25 |
| 反应后质量/g | 未测 | 21 | 10 | 9 |
| A. | 该反应为分解反应 | B. | X中未测值为0 | ||
| C. | 若Q为氧气,则该反应为氧化反应 | D. | 该反应遵循质量守恒定律 |
6.只用一种试剂就可把氢氧化钡、盐酸、氢氧化钾区别开来,该试剂是( )
| A. | pH试纸 | B. | 碳酸钾溶液 | C. | 水 | D. | 酚酞试液 |