题目内容
4.经实验测得某一溶液由Na+、Mg2+、Cl-、SO42-四种离子组成,其中含有4.6gNa+、14.4克SO42-、14.2克Cl-,则Mg2+的质量为( )| A. | 2.4克 | B. | 5克 | C. | 6克 | D. | 4.8克 |
分析 由题意可知,某一溶液由Na+、Mg2+、Cl-、SO42-四种离子组成,其中含有4.6克Na+、14.4克SO42-、14.2克Cl-,由各种离子质量及相对原子质量得出Na+、Mg2+、Cl-的离子的个数比:$\frac{4.6g}{23}$:$\frac{14,4g}{96}$:$\frac{14.2g}{35.5}$=4:3:8,设Na+的个数是4x,则SO42-个数是3x,Cl-个数是8x,再设Mg2+-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+2y=3x×2++8x,所以,y=5x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由 离子的个数关系及质量可以求出Mg2+-质量.
解答 解:因为某一溶液由Na+、Mg2+、Cl-、SO42-四种离子组成,其中含有4.6克Na+、14.4克SO42-、14.2克Cl-,由各种离子质量及相对原子质量得出Na+、Mg2+、Cl-的离子的个数比:$\frac{4.6g}{23}$:$\frac{14,4g}{96}$:$\frac{14.2g}{35.5}$=4:3:8,设Na+的个数是4x,则SO42-个数是3x,Cl-个数是8x,再设Mg2+-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+2y=3x×2++8x,所以,y=5x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由Na+、Mg2+-个数比为4:5,求出Na+、Mg2+质量之比为(23×4):(24×5)=23:30,由Na+的质量是4.6克,所以,Mg2+的质量是6g,所以,A、B、D错误,C正确.
故选C.
点评 在溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等,巧妙利用这个等量关系可以找出一些微粒之间个数关系,进行有关的计算.

| A. |  | B. |  | C. |  | D. |  |
| A. |  | B. |  | C. |  | D. |  |
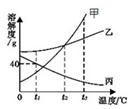 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )| A. | 甲溶液 | B. | 乙溶液 | C. | 丙溶液 | D. | 甲乙丙均可 |

| A. | CO2 Fe2O3 | B. | Na2CO3 NaCl | C. | KOH Ba(OH)2 | D. | HNO3 H2CO3 |
| A. | 将碳酸钠固体放入稀硫酸中有大量气泡产生 | |
| B. | 将稀盐酸滴入氢氧化钠溶液中观察不到明显变化 | |
| C. | 在电解水实验中,正极产生的气体比负极产生的气体体积小 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色四氧化三铁固体 |




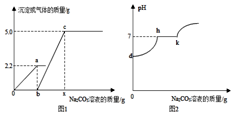 小科同学在实验室制取CO2气体后,对废液进 行探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示:加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,请写出h-k段的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl,a点溶液中所含溶质为NaCl和CaCl2(用化学式表示).
小科同学在实验室制取CO2气体后,对废液进 行探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示:加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,请写出h-k段的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl,a点溶液中所含溶质为NaCl和CaCl2(用化学式表示).